当氢原子的一个电子从第二能级跃迁到第一能级时,发射出光的波长是121.6 nm;当电子从第三能级跃迁到第二能级时,发射出光子的波长是656.3 nm。
试回答:
(1)哪一种光子的能量大?说明理由。
(2)求氢原子中电子的第三和第二能级的能量差及第二和第一能级的能量差。说明原子中的能量是否连续。
钠及其化合物具有广泛的用途。
(1)工业上制备金属钠的常用方法是____________。试写出制备金属钠的化学方程式。金属钠可用于(写出Na在熔点低方面的一种用途)。
(2)用Na2CO3熔融盐作电解质,CO、O2、CO2为原料可组成新型电池。该电池的结构如图所示:
①正极的电极反应式为___________,电池工作时物质A可循环使用,A物质的化学式为_____________。
②请写出检验Na2CO3中钠元素的方法。
(3)常温下,浓度均为0.1 mol·L-1的下列五种钠盐溶液的pH如下表:
| 溶质 |
CH3COONa |
Na2CO3 |
NaClO |
NaCN |
| pH |
8.8 |
11.6 |
10.3 |
11.1 |
上述盐溶液的阴离子中,结合H+能力最强的是,根据表中数据,浓度均为0.01 mol·L-1的下列四种酸的溶液分别稀释100倍,pH变化最大的是_______(填序号)。
a.HCN b.HClO c.CH3COOHd.H2CO3
(4)实验室中常用NaOH来进行尾气处理、洗气和提纯。
①常温下,当300 mL 1 mol·L-1的NaOH溶液吸收4.48 L(折算成标准状况)SO2时,所得溶液pH>7,则溶液中各离子浓度由大到小的顺序为________________________。
②已知几种离子开始沉淀时的pH如下表:
| 离子 |
Fe2+ |
Cu2+ |
Mg2+ |
| pH |
7.6 |
5.2 |
10.4 |
当向含相同浓度Cu2+、Mg2+、Fe2+的溶液中滴加某浓度的NaOH溶液时,________(填离子符号)先沉淀,Ksp[Fe(OH)2]______Ksp[Mg(OH)2](填“>”、“=”或“<”)。
如下表所示为元素周期表的一部分,参照元素①~⑦在表中的位置,请回答下列问题:
| 族 周期 |
IA |
0 |
||||||
| 1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
| 2 |
② |
③ |
||||||
| 3 |
④ |
⑤ |
⑥ |
⑦ |
(1)③、④、⑦的原子半径由大到小的顺序为(用元素符号表示)。
(2)⑥和⑦的最高价含氧酸的酸性强弱为(用酸的化学式表示)。
(3)①、②两种元素按原子个数之比为1:1组成的常见液态化合物,在酸性溶液中能将Fe2+氧化,写出该反应的离子方程式 ;
(4)由表中元素形成的物质可发生如图中的反应,其中B、C、G是单质,B为黄绿色气体,D溶液显碱性。
①写出D溶液与G反应的化学方程式。
②写出检验A溶液中溶质的阴离子的方法。
③常温下,若电解1L0.1 mol·L-1的A溶液,一段时间后测得溶液pH为12(忽略溶液体积变化),则该电解过程中转移电子的物质的量为。
④写出过量的E与F溶液中溶质反应的离子方程式。
(5)由②、④、⑥元素组成的化合物W(在酸性溶液中发黄,W还原性较强),在溶液中易被⑦的单质氧化,该反应的离子方程式为 。
高铁酸盐是一种强氧化剂,在能源、环保等方面均有广泛的用途。湿法、干法制备高铁酸钾的原理如下表所示:
| 湿法 |
强碱介质中,Fe(NO3)3与NaClO反应得到紫红色高铁酸盐溶液 |
| 干法 |
Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸钾(K2FeO4)和KNO2等产物 |
(1)某工厂用湿法制备高铁酸钾的流程如图所示: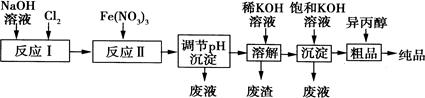
①反应I的化学方程式为。
②反应Ⅱ的离子方程式为。
③已知25℃时Fe(OH)3的Ksp=4.0×10—38,反应Ⅱ后的溶液中c(Fe3+)=4.0×10—5mol·L—1.则需调整pH=时,开始生成Fe(OH)3沉淀(不考虑溶液体积的变化)。
(2)由流程图可见,湿法制备高铁酸钾时,需先制得高铁酸钠,然后再向高铁酸钠溶液中加入饱和KOH溶液,即可析出高铁酸钾。
①已知高铁酸钠和水反应,有Fe(OH)3和O2生成,则高铁酸钠的氧化性比O2(填“强”或“弱”)。
②由以上信息可知:高铁酸钾的溶解度比高铁酸钠(填“大”或“小”)。
(3)高铁酸钾是一种理想的水处理剂,其处理水的原理为。
(4)干法制备K2FeO4的反应中氧化剂与还原剂的物质的量之比为。
液晶高分子材料应用广泛。新型液晶基元——化合物Ⅳ的合成线路如下:
(1)化合物Ⅰ的分子式为________,1 mol化合物Ⅰ最多可与________mol NaOH反应。
(2)CH2=CH—CH2Br与NaOH水溶液反应的化学方程式为(注明条件)______________。
(3)化合物Ⅰ的同分异构体中,苯环上一溴代物只有2种且能发生银镜反应的化合物有多种,写出其中一种同分异体的结构简式____________________。
(4)下列关于化合物Ⅱ的说法正确的是_______(填字母)。
| A.属于烯烃 | B.能与FeCl3溶液反应显紫色 |
| C.一定条件下能发生加聚反应 | D.能使溴的四氯化碳溶液褪色 |
(5)反应③的反应类型是________。在一定条件下,化合物 也可与Ⅲ发生类似反应③的反应生成有机物Ⅴ。Ⅴ的结构简式是__________。
也可与Ⅲ发生类似反应③的反应生成有机物Ⅴ。Ⅴ的结构简式是__________。
硫元素有多种化合价,可形成多种化合物。
(1)常温下用1mol•L-1 100 mL NaOH溶液恰好完全吸收0.1mol SO2气体,此反应的离子方程式为;该溶液pH<7的原因是(结合方程式回答)。以石墨作电极,电解该物质的饱和溶液时,只有一个电极产生气体,写出阳极的电极反应式。
(2)请按照浓度由大到小的顺序排列0.1mol/LNa2SO3溶液中的离子。Na2SO3溶液放置于空气中一段时间后,溶液的pH(填“增大”“减小”或 “不变”)。
(3)某同学在常温下设计如下实验流程探究Na2S2O3的化学性质。
实验①可说明(填字母)
| A.该Na2S2O3溶液中水电离的c(OH—)=10—8mol/L |
| B.H2S2O3是一种弱酸 |
| C.Na2S2O3是一种弱电解质 |
D.Na2S2O3水解方程式为S2O32—+2H2O H2S2O3+2OH— H2S2O3+2OH— |
写出实验②发生反应的离子方程式。
(4)实验室制得的Na2S2O3粗晶体中往往含有少量杂质。为了测定粗产品中Na2S2O3·5H2O的含量,一般采用在酸性条件下用KMnO4标准液滴定的方法(假定粗产品中杂质与酸性KMnO4溶液不反应)。
称取1.28 g的粗样品溶于水,用0.40mol/L KMnO4溶液(加入适量硫酸酸化)滴定,当溶液中S2O32—全部被氧化时,消耗KMnO4溶液体积20.00 mL。
5S2O32—+8MnO4—+14H+ =8Mn2++10SO42—+7H2O)。试回答:
①此滴定实验是否需要指示剂(填“是”或“否”),KMnO4溶液置于(填“酸式”或“碱式”)滴定管中。
②若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则会使样品中Na2S2O3·5H2O的质量分数的测量结果(填“偏高”“偏低”或“不变”)。
③产品中Na2S2O3·5H2O的质量分数为。(Na2S2O3·5H2O式量:248)(保留小数点后两位数)