已知某温度下:
反应①:CO2(g)+H2(g) CO(g)+H2O(g),ΔH=" +41.2" kJ/mol;
CO(g)+H2O(g),ΔH=" +41.2" kJ/mol;
反应②: (g)
(g)
 (g)+H2(g),ΔH=" +117.6" kJ/mol。
(g)+H2(g),ΔH=" +117.6" kJ/mol。
①、②的化学反应平衡常数分别为K1、K2。
(1)请写出二氧化碳氧化乙苯制备苯乙烯的热化学反应方程式 。该反应的化学平衡常数K= (用K1、K2表示)。
(2)恒温恒容条件下,反应①达到平衡后,t1时刻通入少量CO2。请画出t1之后的正逆反应曲线,并作出标注。
(3)一定条件下,某密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.50mol/L、c(N2O4)="0.125" mol/L,则2NO2(g) N2O4(g)的平衡常数K= (写出计算结果) ;若NO2起始浓度为2 mol/L,在相同条件下反应达到平衡时,NO2的转化率为 。
N2O4(g)的平衡常数K= (写出计算结果) ;若NO2起始浓度为2 mol/L,在相同条件下反应达到平衡时,NO2的转化率为 。
(4)在一定体积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
| T/℃ |
700 |
800 |
830 |
1 000 |
1 200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
①该反应为________反应(填“吸热”、“放热”)。
②能使该反应的反应速率增大,且平衡向正反应方向移动的是 。
A.及时分离出CO气体 B.适当升高温度
C.增大CO2的浓度 D.选择高效催化剂
含硫化合物在工业生产中有广泛的用途。
(1)SO2可用于工业生产SO3。
①在一定条件下,每生成8g SO3气体,放热9.83kJ。该反应的热化学方程式为________。
②在500℃,催化剂存在的条件下,向容积为1L的甲、乙两个密闭容器中均充入 2 mol SO2和1 mol O2。甲保持压强不变,乙保持容积不变,充分反应后均达到平衡。
I.平衡时,两容器中SO3体积分数的关系为:甲_______乙(填“>”、“<”或“ =”)。
II.若乙在t1 min时达到平衡,此时测得容器乙中SO2的转化率为90%,则该
反应的平衡常数为_______;保持温度不变,t2 min时再向该容器中充入1 mol SO2和1 mol SO3,t3min时达到新平衡。请在下图中画出t2~t4 min内正逆反应速率的变化曲线(曲线上必须标明V正、V逆)
(2)硫酸镁晶体(MgSO4·7H2O )在制革、医药等领域均有广泛用途。4.92g硫酸镁晶体受热脱水过程的热重曲线(固体质量随温度变化的曲线)如右图所示。
①固体M的化学式为__________。
②硫酸镁晶体受热失去结晶水的过程分为_________个阶段。
③N转化成P时,同时生成另一种氧化物,该反应的化学方程式为_________。
【物质结构与性质】
根据元素周期表中第四周期元素的相关知识,回答下列问题:
(1)第四周期元素的基态原子的电子排布中4s轨道上只有1个电子的元素有________种;写出Cu+的核外电子排布式________。
(2)按电子排布,可将周期表里的元素划分成五个区域,第四周期元素中属于s区的元素有________种,属于d区的元素有________种。
(3)CaO晶胞如所示,CaO晶体中Ca2+的配位数为;CaO的焰色反应为砖红色,许多金属或它们的化
合物都可以发生焰色反应,其原因是_______。
(4)由叠氮化钾(KN3)热分解可得纯N2:2KN3(s)=2K(l)+3N2(g),下列有关说法正确的是_______(填选项字母)。
A NaN3与KN3结构类似,前者晶格能较小
B晶体钾的晶胞结构如图所示: ,每个晶胞中分摊2个钾原子
,每个晶胞中分摊2个钾原子
C氮的第一电离能大于氧
D氮气常温下很稳定,是因为氮的电负性小
(5)二氧化钛(TiO2)是常用的、具有较高催化活性和稳定性的光催化剂。O2在其催化作用下,可将CN-氧化成CNO-。CN-的电子式为_______,CNO-的中心原子的杂化方式为______。
(6)在CrCl3溶液中,一定条件下存在组成为[CrCln(H2O)6-n]x+ (n和x均为正整数)的配离子,将其通过氢离子交换树脂(R-H),可发生离子交换反应:
[CrCln(H2O)6-n]X++ xR- Rx[CrCln(H2O)6-n]+xH+。将含0.0015 mol[CrCln(H2O)6-n]x+的溶液,与R-H完全交换后,中和生成的H+需浓度为0.1200 mol·L-1NaOH溶液25.00 mL,则该配离子的化学式为_______。
Rx[CrCln(H2O)6-n]+xH+。将含0.0015 mol[CrCln(H2O)6-n]x+的溶液,与R-H完全交换后,中和生成的H+需浓度为0.1200 mol·L-1NaOH溶液25.00 mL,则该配离子的化学式为_______。
人民网2012年11月8日西宁电,青海盐湖海纳化工有限公司15万吨电石项目投产。以电石(CaC2 )为原料可生产许多重要的有机物质,电石可由CaO制得(同时还得到一种可燃性气体物质),有关转化关系如下图所示
(1)写出制备电石及由电石生成乙炔的化学方程式为__________________、__________________。
(2)基态Ca2+的电子排布式为______________,上面转化关系图中涉及到的元素中,电负性最大的元素是______________,第一电离能最小的元素是________________。
(3)乙炔、乙烷分子中的碳原子杂化类型分别为________________、______________,甲烷的空间构型是________________,该空间构型中,键角__________(填>、<、=)109°28′。
(4)与CH2=CH2相比,CH2=CHCl属于易液化的气体,原因是___________________。
(5)假设下图是电石的晶胞,则一个晶胞中含有________个钙离子,研究表明,亚玲形C的存在,使晶胞沿一个方向拉长,则该晶胞中一个Ca2+周围距离相等且最近的C有________个。
【化学与技术】
由黄铜矿(主要成分是CuFeS2)炼制精铜的工艺流程示意图如下: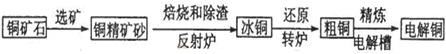
(1)在反射炉中,把铜精矿砂和石英砂混合加热到1000℃左右,黄铜矿与空气反应生成Cu和Fe的低价硫化物,且部分Fe的硫化物转化为低价氧化物。该过程中两个主要反应的化学方程式是、,反射炉内生成炉渣的主要成分是;
(2)冰铜(Cu2S和FeS互相熔合而成)含Cu量为20%~50%。转炉中将冰铜加熔剂(石英砂)在1200℃左右吹入空气进行吹炼。冰铜中的Cu2S被氧化成Cu2O,生成的Cu2O与Cu2S反应,生成含Cu量约为98.5%的粗铜,该过程发生反应的化学方程式是、;
(3)粗铜的电解精炼如图所示。
在粗铜的电解过程中,粗铜板是图中电极(填图中的字母);在电极d上发生的电极反应为;若粗铜中还含有Au、Ag、Fe,它们在电解槽中的存在形式和位置为。
【物质结构与性质】
X、Y、Z、M、N、Q为元素周期表前四周期的六种元素。其中X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,M的内层电子数是最外层电子数的9倍,N的原子序数比M小1, Q在元素周期表的各元素中电负性最大。请回答下列问题:
(1)X元素在周期表中的位置是,属区元素,它的最外层电子的电子排布图为。
(2)XZ2分子的立体结构是,YZ2分子中Y的杂化轨道类型为,相同条件下两者在水中的溶解度较大的是(写分子式),理由是。
(3)含有元素N的盐的焰色反应为色,许多金属盐都可以发生焰色反应,其原因是。
(4)元素M与元素Q形成晶体结构如图所示,设其晶胞边长为a pm,则a位置与b位置之间的距离为_______pm(只要求列算式)。