短周期元素A、B、C、D中,0.5 mol A元素的离子得到6.02×1023个电子被还原为中性原子,0.4 g A的氧化物恰好与100 mL 0.2 mol·L-1的盐酸完全反应。A元素原子核内质子数与中子数相等,B元素原子核外M能层电子数比K能层多1,C-的核外电子排布为[Ne]3s23p6,D元素原子核外L能层比K能层多2个电子,请完成:
(1)写出A、B、C、D四种元素的名称。
(2)画出C-和D原子的结构示意图。
(3)向B、C两元素形成的化合物的水溶液中逐滴滴入苛性钠溶液,有什么现象发生?写出有关反应的离子方程式。
分冬青油是天然香料之一,其主要成分为水杨酸甲酯,可由水杨酸(邻羟基苯甲酸)和甲醇作原料在浓硫酸催化下酯化而得。
实验步骤:
Ⅰ.如图,在100 mL三口烧瓶中放入6.9 g (0.05 mol)水杨酸和24 g(30 mL,0.75 mol)甲醇,向混合物中加入约10 mL甲苯,再小心地加入8 mL浓硫酸,摇动混匀:加入1~2粒沸石,装上回流冷凝管在石棉网上保持85—95℃,加热回流1.5-2小时: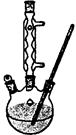
Ⅱ.待装置冷却后,分离出甲醇,向烧瓶中加入50 mL,水,然后转移至分液漏斗,分出下层产物,弃去上层水层,有机层再倒入分液漏斗中;依次用50 mL5%NaHCO3溶液洗1次(溶液呈弱碱性),30 mL水洗一次(产物皆在下层),有机层得到粗酯;
Ⅲ.将粗酯进行蒸馏,收集221℃~224℃的馏分。产品经0.5 g无水CaCl2干燥后称重。
常用物理常数: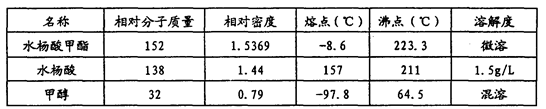
请根据以上信息回答下列问题:
(1)制备冬青油的化学方程式为______________。
(2)制备冬青油时,最合适的加热方法是_______________。实验中加入甲苯作带水剂的目的是____________________。
(3)反应结束冷却后,分离甲醇的操作是:___________________;
(4)在提纯粗产品的过程中,用碳酸氢钠溶液洗涤主要除去的杂质是____________:若
改用氢氧化钠溶液是否可以____________(填“可以”或“不可以”),其原因是________________。
(5)检验产品中是否含有水杨酸的化学方法是__________________。最终称得产品的质量为4.2 g,则所得水杨酸甲酯的产率为___________(保留两位有效数字)。
甲学生对Cl2与FeCl2和KSCN混合溶液的反应进行实验探究。
(1)B中反应的离子方程式是____。
(2)A中溶液变红的原因是____。
(3)为了探究现象II的原因,甲同学进行如下实验。
①取A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在。
②取A中黄色溶液于试管中,加入过量的KSCN溶液,最终得到红色溶液。
甲同学的实验证明产生现象Ⅱ的原因是SCN—与Cl2发生了反应。
(4)甲同学猜想SCN—可能被Cl2氧化了,他又进行了如下研究。
资料显示:SCN—的电子式为
①甲同学认为SCN—中碳元素没有被氧化,理由是。
②取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液,产生白色沉淀,由此证明SCN—中被氧化的元素是。
③通过实验证明了SCN—中氮元素转化为NO3-,他的实验方案是____。
④若SCN—与Cl2反应生成1 mol CO2,则转移电子的物质的量是mol。
2SO2(g)+O2(g) 2SO3(g)是生产硫酸的主要反应之一。下表是原料气按
2SO3(g)是生产硫酸的主要反应之一。下表是原料气按 投料,在
投料,在 时,不同温度下SO2的平衡转化率。
时,不同温度下SO2的平衡转化率。
(1)该反应是_反应(填“放热”或“吸热”)。
(2) 时,将含10 mol SO2的原料气通入一密闭容器中进行反应平衡时SO2的物质的量是mol。
时,将含10 mol SO2的原料气通入一密闭容器中进行反应平衡时SO2的物质的量是mol。
(3)硫酸厂尾气(主要成分为SO2、O2和N2)中低浓度SO2的吸收有很多方法。
①用氨水吸收上述尾气,若尾气中SO2与氨水恰好反应得到弱碱性的(NH4)2SO3溶液,则有关该溶液的下列关系正确的是(填序号)。
②用MnO2与水的悬浊液吸收上述尾气并生产MnSO4
i.得到MnSO4的化学方程式是
ii.该吸收过程生成MnSO4时,溶液的pH变化趋势如图甲,SO2的吸收率与溶液pH的关系如图乙。
图甲中pH变化是因为吸收中有部分SO2转化为H2SO4生成H2SO4反应的化学方程式是____;由图乙可知pH的降低SO2的吸收(填“有利于”或“不利于”),用化学平衡移动原理解释其原因是。
硒34Se和碲52Te都是第VIA族元素,硒是分布在地壳中的稀有元素。工业上用硒鼓废料(主要成分硒、碲、碳、铜和铁合金)回收精炼硒的流程如下:
已知:
(1)Se的氢化物的电子式是____。
(2)步骤①中通人的氧气使硒鼓废料翻腾,目的是。
(3)废气的主要成分是____;废渣II的主要成分是。
(4)步骤④中主要反应的化学方程式是;步骤⑥反应的化学方程式是。
(5)根据表中数据,步骤⑤最适宜的分离方法是。
有机物5一甲基 是一种医药合成中间体,某同学设计它的合成路线如下:
是一种医药合成中间体,某同学设计它的合成路线如下:
(1)①的反应类型是。
(2)E的结构简式是。
(3)A的结构简式是;③的反应条件和所需无机试剂是。
(4)下列有关5一甲基茚( )的说法正确的是(填序号)。
)的说法正确的是(填序号)。
| A.一定条件下能与卤素单质发生取代反应 |
| B.1 mol该物质最多与4 mol H2发生加成反应 |
| C.一定条件下能发生加聚反应生成高分子化合物 |
| D.与溴的四氯化碳溶液反应得到的产物不能使高锰酸钾酸性溶液褪色 |
(5)反应⑧的化学方程式是。
(6)满足下列条件的G的同分异构体有种;写出其中一种的结构简式。
①分子中含有苯环且苯环上只有一个取代基;②能发生银镜反应。