氧化还原反应是重要的一类化学反应。
(1)在化学反应2KMnO4 + 10KI + 8H2SO4=6K2SO4+ 2MnSO4 + 5I2 + 8H2O中,化合价降低的元素是 ,发生氧化反应的物质是 。
(2)据反应8NH3 + 3Cl2=6NH4Cl + N2回答下列问题:
①该反应中,氧化剂是 ,还原剂是 。
②该反应中,当有8mol NH3反应时,转移电子总量是 mol。
③参加反应的氧化剂与还原剂的物质的量之比为 (最简整数比)。
④当有3mol e- 转移时,该反应生成的氧化产物的质量是 g。
已知有A、B、C、D、E五种短周期元素,核电荷数依次增加。
| 元素 |
有关性质及结构信息 |
| A |
形成的单质密度最小 |
| B |
基态原子核外L层的P电子数等于S电子数 |
| C |
原子核外有8种运动状态不同的电子 |
| D |
海水中含量最高的金属元素 |
| E |
E的氧化物是形成酸雨的主要物质之一 |
(1)甲是由A、B、C三种元素组成的相对分子质量最小的物质。由甲中的两种元素组成,且与甲等电子的物质的电子式是,该物质与C的单质在KOH溶液中形成燃料电池的负极反应式为。
(2)均由A、C、D、E四种元素组成的两种物质丙和丁在溶液中可发生反应,该化学方程式为 。
(3)由A、B两种元素组成的气体分子有多种,其中乙是一个含4个原子的分子,乙的结构式为。已知乙的燃烧热为1200 kJ∕mol,乙燃烧热的热化学反应方程式为。
(4)A与C可形成一种物质戊,在酸性条件下,将少量戊加入淀粉KI溶液后,溶液显蓝色,反应的离子方程式为。用酸性高锰酸钾溶液滴定法可测定戊溶液中戊的含量,若滴定中消耗0.50mol/L的高锰酸钾溶液40.00mL,则此溶液中戊的质量为____________ g。
(5)E2-基态核外电子排布式为,在A、B、C形成的多种分子中,有些分子的核磁共振氢谱显示有三种氢,且峰面积比为1﹕2﹕3,写出其中一种分子的名称:。
已知一定温度和压强下,在容积为VL的密闭容器中充入1mol A和1mol B,保持恒温恒压下反应:A(g) + B(g)  C(g),△H<0。达到平衡时,C的体积分数为40%。试回答有关问题:
C(g),△H<0。达到平衡时,C的体积分数为40%。试回答有关问题:
(1)升温时,C的反应速率_______(填“加快”、“减慢”或“不变”)
(2)若平衡时,保持容器容积不变,使容器内压强增大,则平衡_______
| A.一定向正反应方向移动 | B.一定向逆反应方向移动 |
| C.一定不移动 | D.不一定移动 |
(3)若使温度、压强在上述条件下恒定不变,在密闭容器中充入2mol A和2 mol B,则反应达到平衡时,C的体积分数为_____;容器的容积为____(请写出计算过程)
1840年盖斯指出:若是一个反应可以分几步进行,则各步反应的反应热总和与这个反应一次发生时的反应热相同。请回答:
(1)已知热化学方程式:C(S,金刚石)+ O2(g)= CO2(g) △H = -395.41KJ/mol
C(S,石墨)+ O2(g)= CO2(g) △H = -393.51KJ/mol
则金刚石转化为石墨的热化学方程式为____________________,由热化学方程式看来更稳定的碳的同素异形体是____________________
(2)燃烧3.1g白磷比燃烧3.1g红磷放出的热量多1.839KJ,则白磷转化为红磷的热化学方程式是____________________________,相同温度下,能量状态最低的是__________。
已知A的产量通常用来衡量一个国家的石油化工水平,现以A为主要原料合成一种具有果香味的物质E,其合成路线如下图所示。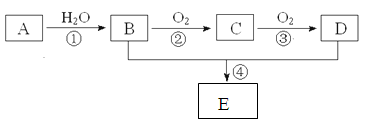
请回答下列问题:
(1)写出A的电子式,B、D分子中的官能团名称分别是 、。
(2)写出下列反应的化学方程式,并注明反应类型:
①,;
②,;
④,。
(12分)现有反应:mA(g)+nB(g) pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
(1)该反应的逆反应为_________热反应,且m +n ________ p(填“>”“=”“<”)。
(2)减压时,A的质量分数_________。(填“增大”“减小”或“不变”,下同)
(3)若加入B(体积不变),则A的转化率__________。
(4)若升高温度,则平衡时B、C的浓度之比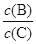 将_________。
将_________。
(5)若B是有色物质,A、C均无色,则加入C(体积不变)时混合物颜色_______ (填“变深”“变浅”或“不变”)。