化学是一门以实验为基础的自然科学。
(1)下列说法中,符合实验安全规范要求的是 (填序号字母)。
① 闻气体的气味时,应用手在瓶口轻轻煽动,使少量的气体飘进鼻孔
② 在实验室做铜和浓硝酸反应制备二氧化氮的实验时,应该在通风橱中进行
③做H2还原CuO实验时,先加热CuO至高温,然后立即通入H2使反应发生
④实验中当有少量的过氧化钠剩余时,用纸包裹好后将其放入垃圾桶中
(2)某学习小组用右图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应及部分产物的性质(装置中的铜丝可适当上下抽动)。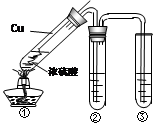
① 当反应进行一段时间后,欲使反应迅速停止,可采取的措施为 。
② 若装置②用来检验生成的气体产物的性质,在装置②的试管中加入的试剂为品红试液,通入气体后,现象为 ,此现象证明该气体产物具有 性。
③ 装置③中盛有某单质的水溶液,用来检验气体产物的还原性,则该单质的水溶液为
,反应的化学方程式为 。
④ 实验最后,要将图①大试管中的液体与水混合,以观察颜色检验存在的离子,从安全角度考虑,混合的方法应该是 。
⑤ 实验中,在所用仪器及仪器间连接都完好的情况下,同学们仍闻到了较强的刺激性气味,说明此实验的整套装置设计有缺陷,会造成空气污染。改进此实验装置的方法是 。
在0.24 L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示,回答下列问题。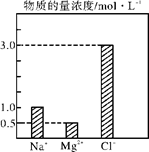
(1)该混合液中,NaCl的物质的量为______mol,含溶质MgCl2的质量为________g。
(2)该混合液中CaCl2的物质的量为________mol,将该混合液加水稀释至体积为1200mL,稀释后溶液中Ca2+的物质的量浓度为______mol·L-1。
(3)向该稀释后的溶液中加入足量硝酸酸化的硝酸银溶液,可得到沉淀________mol。
化学是一门以实验为基础的自然科学,右图为某试剂瓶上的标签,试回答下列问题。
(1)该盐酸中HCl的物质的量浓度为________mol·L-1。
(2)取用任意体积的该盐酸时,下列物理量中随所取体积的多少而变化的是________。
| A.溶液中HCl的物质的量 |
| B.溶液的浓度 |
| C.溶液中Cl-的数目 |
| D.溶液的密度 |
(3)某学生欲用上述较浓盐酸和蒸馏水配制500 mL物质的量浓度为0.150 mol·L-1的稀盐酸。
①该学生需要量取________mL上述较浓盐酸进行配制。
②在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(在括号内填A表示“偏小”,填B表示“偏大”,填C表示“无影响”)
a.用量筒量取浓盐酸时俯视观察凹液面( )。
b.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水( )。
c.配溶液用的容量瓶用蒸馏水洗涤后未经干燥( )。
化学实验是学习化学的基础,要通过实验去学习化学。
(1)下列关于实验的叙述中正确的有________。
| A.不慎碰翻燃着的酒精灯使酒精在桌面上燃烧起来,应立即用湿抺布灭火 |
| B.不慎将酸沾到皮肤或衣物上,应立即用浓NaOH溶液清洗 |
| C.用托盘天平称量物品质量时,物品应置于右盘 |
| D.实验时应节约药品,实验剩余的药品应放回原试剂瓶 |
E.可燃性气体点燃前一定要验纯
F.使用分液漏斗前必须检查其是否漏水
(2)请将下列错误实验操作可能会引起的不良后果填在表格中。
| 实验 |
向试管中加锌粒 |
对量筒中液体读数 |
浓硫酸的稀释 |
| 错误操作 |
 |
 |
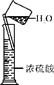 |
| 不良后果 |
如图,有甲、乙两容器,甲体积可变压强不变,乙保持体积不变。向两容器中分别充入1molA、3molB,此时两容器体积均为500mL,温度为T℃。保持温度不变发生反应:A(g)+3B(g) 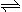 2C(g)+D(s) ΔH<0
2C(g)+D(s) ΔH<0
(1)下列选项中,能表明甲和乙容器中反应一定达到平衡状态的是 。
A.混合气体的总质量不随时间改变
B.2 v正(C) = 3v逆(B)
C.A、B转化率相等
D.物质D的质量不随时间改变
(2)2min后甲容器中反应达到平衡,测得C的浓度为2mol/L,此时甲容器的体积为_______mL。
(3)当甲乙两容器中反应都达平衡时,甲和乙中B的转化率α甲(B) _________α乙(B)。(填“>”“<”或“=”)
(4)其它条件不变,甲中如果从逆反应方向开始反应建立平衡,要求平衡时C的物质的量与(2)中平衡时C的物质的量相等,则需要加入C的物质的量n(C)=________mol,加入D的物质的量n(D)应该满足的条件为______________。
有A、B、C三瓶失去标签的无色溶液:K2CO3、BaCl2、Na2SO4。将它们分别与H2SO4作用,A产生白色沉淀,B产生无色气体,C中无明显现象。则A的名称是______,B的名称是______, C的化学式为______。反应的化学方程式分别为: , 。