根据表中信息判断,下列选项不正确的是
| 序号 |
反应物 |
产物 |
| ① |
KMnO4、H2O2、H2SO4 |
K2SO4、MnSO4… |
| ② |
Cl2、FeBr2 |
FeCl3、FeBr3 |
| ③ |
MnO4-… |
Cl2、Mn2+… |
A.第①组反应的其余产物为H2O和O2
B.第②组反应中Cl2与FeBr2的物质的量之比为1∶2
C.第③组反应中生成1 mol Cl2,转移电子2 mol
D.氧化性由强到弱顺序为MnO4->Cl2>Fe3+>Br2
下列叙述正确的是
| A.标准状况下,1.12 L16O2和1.12 L18O2均含有0.1NA个氧原子 |
| B.第三周期非金属元素含氧酸的酸性从左到右依次增强 |
| C.能使甲基橙显红色的溶液中大量存在:Mg2+、Fe2+、Cl—、NO—3 |
| D.从C(石墨)=C(金刚石);ΔH=+1.9 kJ·mol-1,可知金刚石比石墨更稳定 |
课堂学习中,同学们利用铝条、锌片、铜片、导线、电流计、橙汁、烧杯等用品探究原电池的组成。下列结论错误的是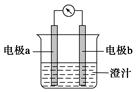
| A.原电池是将化学能转化成电能的装置 |
| B.原电池由电极、电解质溶液和导线等组成 |
| C.图中a极为铝条、b极为锌片时,导线中会产生电流 |
| D.图中a极为锌片、b极为铜片时,电子由铜片通过导线流向锌片 |
下列实验装置设计正确的是 
中国科学技术大学的钱逸泰教授等以CCl4和金属钠为原料,在700℃时制造出纳米级金刚石粉末。该成果发表在世界权威的《科学》杂志上,立刻被科学家们高度评价为“稻草变黄金”。同学们对此有下列一些理解,其中错误的是
| A.金刚石属于金属单质 | B.制造过程中元素种类没有改变 |
| C.CCl4是一种化合物 | D.这个反应是置换反应 |