据报道,最新合成的有机物A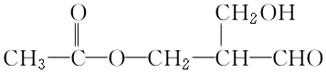 为具有光学活性的物质。
为具有光学活性的物质。
(1)若要使A通过反应失去光学活性,则发生的反应类型不可能是________(填代号)。
| A.酯化反应 | B.水解反应 |
| C.氧化反应 | D.还原反应 |
E.消去反应 F.加成反应
G.银镜反应
(2)某链烃B的分子式为C7H10,在B的各种结构(不考虑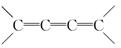 结构)中,都含有手性碳原子,且与足量H2发生加成反应后仍具有光学活性的有机物有五种,已知其中两种的结构简式为:
结构)中,都含有手性碳原子,且与足量H2发生加成反应后仍具有光学活性的有机物有五种,已知其中两种的结构简式为: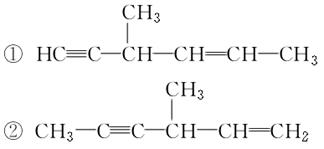
另三种结构简式为
________________________________________________________________________,
______________________,________________________。
(6分)①Cu、②液氨、③氯化钠晶体 、④硫酸溶液、⑤干冰、⑥BaSO4、⑦金刚石、⑧蔗糖、⑨H2S
上述物质中,能导电的是,属于电解质的是,属于非电解质的是。(填序号)
有机物A可作为合成降血脂药物安妥明( )和
)和
某聚碳酸酯工程塑料
( )的原料之一。
)的原料之一。
已知:
①如下有机物分子结构不稳定,会发生反应: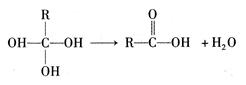
②某些醇或酚可以与碳酸酯反应生成聚碳酸酯,如:
相关的合成路线如下图所示:
(1)经质谱测定,有机物A的相对分子质量为58,燃烧2.9g有机物A,生成标准状况下3.36L CO2和2.7g H2O,A的核磁共振氢谱只出现一个吸收峰。则A的分子式是 。
(2)E→安妥明反应的化学方程式是 。
(3)C可能发生的反应类型是(填选项序号) 。
a. 取代反应 b. 加成反应 c. 消去反应 d. 还原反应
(4)F的结构简式是 。
(5)写出同时符合下列条件的E的同分异构体X的结构简式(只写1种即可)
。
①X能与饱和溴水发生取代反应
②X的苯环上有2个取代基,且苯环上的一溴取代物只有2种
③1mol X与足量NaHCO3溶液反应生成1mol CO2,与足量Na反应生成1mol H2
④X与NaOH水溶液发生取代反应所生成的官能团能被连续氧化为羧基
有a、b、c、d四种原子序数依次增大的常见短周期元素,a、c结合构成化合物x;b、c结合构成化合物y;c、d结合构成化合物z。元素组成的单质(仍用a、b、c、d表示)和组成的化合物之间的反应关系如下(未配平):
①x+z→c↑+n ②y+z→c↑+m ③n+y→m+x ④d+x→n+a↑
(1)上述反应中,有充分理由说明该反应一定属于氧化还原反应的是
(填反应编号)。
(2)组成化合物n的元素为 (填字母),判断理由为 。
(3)根据题意写出:z的电子式为 ,y的结构式为 。
(4)根据题意写出:反应①的化学方程式 。
环氧树脂是一类重要的热固性塑料。可以利用双酚A与环氧氯丙烷按下式反应制得环氧树脂。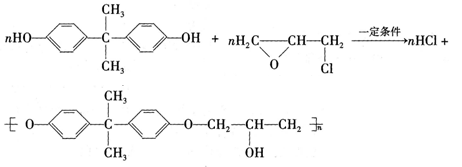
(1)上述反应属于 (填反应类型)。
(2)双酚A是内分泌干扰素,可扰乱人体激素的分泌。双酚A的分子式为 ,分子中一定处于同一平面的原子有 个。
(3)通常条件下,双酚A能与浓溴水发生反应,则1mol双酚A可消耗 mol Br2。
(4)环氧氯丙烷易燃,有毒性,是致癌物质。环氧氯丙烷有如下转化关系:
①A是一种常见烃,能使酸性高锰酸钾溶液褪色,A的结构简式为 。
②C具有左右对称结构,C→甘油的化学反应方程式为 ,B→C的化学反应方程式为 。
③生成D的反应与制环氧树脂的反应类似,D的结构简式为 。
④C的同类同分异构体共有 种(包括C本身,已知“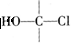 ”不稳定)。
”不稳定)。
V、W、X、Y、Z五种短周期元素的原子序数依次增大,在周期表中W与V、X相邻,Y与Z相邻,X、Y同主族。Z的化合物可以发生某一反应,其离子方程式为: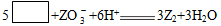 (未完成)。
(未完成)。
(1)Y、Z两种元素的简单离子的半径大小关系为 (用离子符号表示)。
(2)五种元素中分子的空间构型相同的氢化物沸点高低排列顺序为
(用分子式表示),其原因是 。
(3)V与Z单质不能直接化合生成VZ4,在催化剂作用下由VY2与Z2反应制得VZ4,其化学反应方程式为VY2+Z2→VZ4+Y2Z2(未配平)。
①写出上述化学反应方程式 。
②Y2Z2分子中,Y与Z均满足8e-结构,则Y2Z2的结构式为 。
③Y与W两种元素形成一种重要化合物A,A分子的结构如图所示: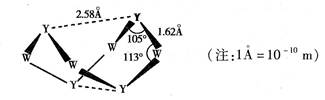
6mol Y2Z2与16mol W的简单氢化物恰好完全反应生成A、Y单质和一种中学化学中常见的盐。写出该反应的化学方程式: 。