(16分)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,合成氨工业在国民生产中有重要意义。以下是关于合成氨的有关问题,请回答:
(1)若在一容积为2 L的密闭容器中加入0.2 mol的N2和0.6 mol的H2在一定条件下发生反应: N2(g) +3H2(g) 2NH3(g) ΔH<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2 mol。则前5分钟的平均反应速率v(N2)= 。平衡时H2的转化率为 。
2NH3(g) ΔH<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2 mol。则前5分钟的平均反应速率v(N2)= 。平衡时H2的转化率为 。
(2)平衡后,若要提高H2的转化率,可以采取的措施有 。
A.加了催化剂 B.增大容器体积C.降低反应体系的温度 D.加入一定量N2
(3)若在0.5 L的密闭容器中,一定量的氮气和氢气进行如下反应:
N2(g)+3H2(g) 2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如表所示:
2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如表所示:
| T/℃ |
200 |
300 |
400 |
| K |
K1 |
K3 |
0.5 |
请完成下列问题:
①试比较K1、K2的大小,K1 K2(填“<”“>”或“=”);
②下列各项能作为判断该反应达到化学平衡状态的依据是 (填序号字母)
A.容器内N2、H2、NH3的物质的量浓度之比为1:3:2 B.v(H2)正=3v(H2)逆
C.容器内压强保持不变D.混合气体的密度保持不变
③400℃时,反应2NH3(g) N2(g)+3H2(g)的化学平衡常数为 。当测得NH3、N2和H2物质的量分别为3 mol、2 mol和 1 mol时,则该反应的v(N2)正 v(N2)逆(填“<”“>”或“=”)。
N2(g)+3H2(g)的化学平衡常数为 。当测得NH3、N2和H2物质的量分别为3 mol、2 mol和 1 mol时,则该反应的v(N2)正 v(N2)逆(填“<”“>”或“=”)。
(4)根据化学反应速率和化学平衡理论,联系合成氨的生产实际,你认为下列说法不正确的是 。
A.化学反应速率理论可指导怎样在一定时间内快出产品
B.勒夏特列原理可指导怎样使用有限原料多出产品
C.催化剂的使用是提高产品产率的有效方法
D.正确利用化学反应速率和化学反应限度理论都可以提高化工生产的综合经济效益
(1)水是生活中不可缺少的物质,A是短周期有色气态单质,B是短周期元素组成的固态有色化合物,A与B都可与水发生氧化还原反应,反应中水既不作氧化剂也不作还原剂。请写出A、B分别与水反应的化学方程式:_________________,______________
(2)NaAlO2的水溶液呈碱性,其呈碱性的原因是(用必要的文字和离子方程式表示)_____________
(3)NaNH2可由金属钠与液氨反应得到,遇水产生两种碱。写出NaNH2与水反应的化学方程式__________
(4) 已知常温下AgCl与AgI的溶度积分别是1.0×10-10和1.5×10-16。若向200 mL饱和AgCl溶液中加入等体积的KI溶液,为使饱和溶液中产生AgI沉淀,则所需加入的KI溶液的物质的量浓度最小是______________。
乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物。完成下列各题:
(1)正四面体烷的二氯取代产物有________种。
(2)关于乙烯基乙炔分子的说法正确的是________。
| A.能使酸性KMnO4溶液褪色 |
| B.1摩尔乙烯基乙炔能与3摩尔Br2发生加成反应 |
| C.乙烯基乙炔分子内含有两种官能团 |
| D.等质量的乙炔与乙烯基乙炔完全燃烧时的耗氧量不相同 |
(3)写出与环辛四烯互为同分异构体且属于芳香烃的分子发生加聚反
应的化学方程式
(4)写出与苯互为同系物且一氯取代产物只有两种的物质的结构简式
(举两例):__________________、__________________。
卤代烃在碱性醇溶液中能发生消去反应。例如:
下图是八种有机化合物的转换关系。
请回答下列问题:
(1)上述框图中,属于消去反应的是(填序号).
(2)①是______________(填反应类型),
(3)化合物E是重要的工业原料,写出由D生成E的化学方程式:
___________________________________________________。
(4)C2的结构简式是__________________。
F1的结构简式是________________。
F1和F2互为________________。
(5)上述八种化合物中,属于二烯烃的是________。
二烯烃的通式是________。
已知某烃类化合物A的相对分子质量为84:
(1)若分子中含有一个碳碳双键,且分子中只有一种类型的氢原子
A的结构简式为
A中的碳原子是否都处于同一平面?(填“是”或者“不是”)。
(2)若分子中无碳碳双键,且分子中只有一种类型的氢原子
A的结构简式为
其名称为
请根据官能团的不同对下列有机物进行分类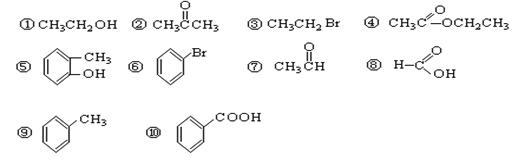
(1)芳香烃: ;(2)卤代烃:;
(3)醇: ;(4)酚: ;(5)醛: ;
(6)酮: ;(7)羧酸: ;(8)酯:。
(Ⅱ)
⑴键线式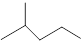 表示的分子式。
表示的分子式。
⑵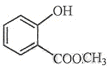 中含有的官能团的名称为。
中含有的官能团的名称为。
⑶书写该物质的名称: