下列关于硫酸性质的描述中,正确的是( )
| A.浓H2SO4有氧化性,稀H2SO4无氧化性 |
| B.由于浓H2SO4具有吸水性,故可用来与蔗糖反应做“黑面包”实验 |
| C.稀H2SO4与铁、铝反应,浓H2SO4在常温下不与铁、铝反应 |
| D.浓硫酸与铜片加热反应,既表现了酸性,又表现出强氧化性 |
下列实验操作正确的是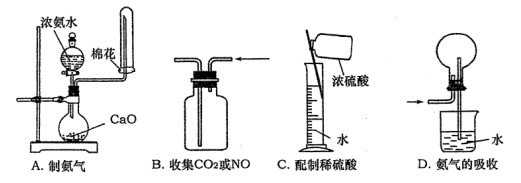
设NA为阿伏加德罗常数的值,下列叙述正确的是
| A.标准状况下,189D2O中所含的质子数为10NA |
| B.28gN2和C0的混合气体中含有的分子数为NA |
| C.标准状况下,11.2LO2参加反应转移的电子数一定为2 NA |
| D.5.6g铁与足量稀硫酸反应失去电子数为0.3 NA |
下列说法正确的是
| A.石油的分馏和煤的于馏都是物理变化 |
| B.可用饱和碳酸钠溶液除去乙酸乙酯中混有的乙酸 |
| C.淀粉、纤维素的化学式都可表示为(C6Hl005)n,二者互为同分异构体 |
| D.淀粉、油脂和蛋白质都是高分子化合物 |
下列反应中,改变反应物的用量或浓度,不会改变反应产物种类的是
| A.碳粉在氧气中燃烧 | B.C02通入氢氧化钠溶液 |
| C.铁在氯气中燃烧 | D.铜和硝酸反应 |
下列说法正确的是
| A.阳离子只有氧化性,阴离子只有还原性 |
| B.失电子难的原子获得电子的能力一定强 |
| C.得到电子越多的氧化剂,其氧化性就越强 |
| D.要实现Fe2+→ Fe3+的转化,必须加入氧化剂 |