某化学课外活动小组用下列装置来制取氧气并验证氧气的化学性质,根据所学化学知识回答下列问题: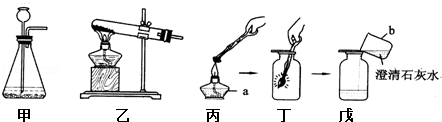
(1)图中a、b表示的仪器名称分别为:a b .
(2)小丁同学用乙装置制取氧气,他选用的试剂是 ,此反应的文字表达式为 ,反应类型为
(3)戊中的现象是 .
2009年2月12日,我外交部就法国某公司拍卖我国两件重要文物兔首和鼠首(见右图),发表严正声明:中国对其拥有不可置疑的所有权。目前我国正在积极追讨这两件文物。兔首和鼠首均为青铜器(铜、锡合金),表面呈绿色,这是铜器长期暴露在空气中生成了铜锈(铜锈俗称铜绿)。为了弄清铜绿的组成和铜生成铜绿的条件,某化学实验小组进行了如下探究:
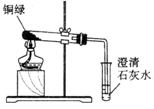
1.探究铜绿的组成
【查阅资料】通过查阅资料知道:铜绿受热易分解。
【设计与实验】
(1)小芳从其它铜器上取下适量的干燥铜绿,按右图所示装置进行实验。在实验过程中,观察到:试管口内有水珠出现,说明了铜绿中含有氢、氧元素;澄清石灰水变浑浊,说明了铜绿中含有元素。
(2)小芳取下少量试管内反应后的剩余物,放入另一支试管中,滴人稀硫酸,充分反应后,溶液变蓝色,说明铜绿中含有元素。
【实验结论】铜绿是由铜、氢、氧和碳元素组成的。
2.探究铜生成铜绿的条件
【查阅资料】铜绿的化学式是Cu2(OH)2CO3,它受热会分解生成三种氧化物。铜绿分解的化学方程式为。
【猜想与假设】据铜绿的组成和查阅的资料判断,铜绿可能是铜与氧气及共同作用而形成的。
【设计与实验】借鉴课本“铁钉锈蚀条件的探究”实验,小梁设计了“铜片锈蚀条件的探究”实验,实验如下图所示(所用铜片洁净、光亮,试管内的“”为铜片):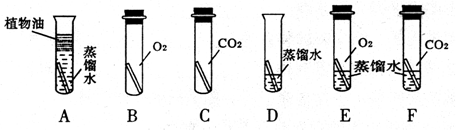
实验较长时间后,发现试管中铜片最先生锈(填试管字母编号)。
【评价与改进】小区认为小梁设计的实验还不够完善,要得出正确的结论,还要补充一个实验。你认为要补充的一个实验是(用图表示亦可)。
【拓展与应用】
小明发现从不同地点收集到的两个铜器(一个是纯铜做的,一个是青铜做的)中,纯铜器的铜绿比青铜器的少,他据此分析认为青铜比纯铜易锈蚀。小明的分析是否全面?请你说明理由。
。
铜器长期暴露在空气中会生成铜绿(俗称铜锈)。铜锈的主要成分是碱式碳酸铜,碱式碳酸铜不稳定,受热分解成黑色固体物质、无色气体和水。这种黑色固体和无色液体的成分是什么呢?
查阅资料:碱式碳酸铜的化学式是Cu2(OH)2CO3。稀硫酸能与Fe2O3、CuO等金属氧化物反应,生成盐和水。
提出猜想:某同学根据碱式碳酸铜的化学式对黑色固体、无色液体的成分做出了一下猜想:
①无色气体为二氧化碳;②黑色固体为氧化铜;③…
实验验证:实验装置如图。
在此实验装置中,大试管的管口略向下倾斜的目的是。
验证①:若猜想①正确,实验过程中应该看到澄清的石灰水。 产生此现象的化学方程式是。在反应完全停止加热时,针对熄灭酒精灯和把导管移出液面这两步操作,你认为应该先进行的操作是。
验证②:从装置中取下大试管并冷却到室温,然后向大试管中加入足量的稀硫酸,充分振荡,静置后观察实验现象。若猜想②正确,观察到得实验现象应该是,发生反应的化学方程式为。
金属钠很软,可以用刀切割。切开外皮后,可以看到钠具有银白色的金属光泽。钠是热和电的良导体。钠的密度是0.97g/cm3,比水的密度小,钠的熔点是97.81℃,沸点是882.9℃。将金属钠放入水中,可以反应生成NaOH和H2;钠跟氧气混合加热生成淡黄色的过氧化钠(Na2O2)固体,钠跟CO2在加热条件下反应生成碳酸钠和单质碳。
(1)试写出钠跟水反应的化学方程式
(2)小刘同学用图A装置做钠跟氧气反应实验,观察到生成物中出现黑色固体,则该黑色固体是(填化学式),试写出相应的化学反应方程式
_________________________________。
(3)为了探究黑色固体成分,小刘同学进行了下列探究。
探究反应中CO2的
猜想①:CO2的来源于 ;猜想②:CO2的来源于 ;
在上述两种来源中,(填序号)是CO2的主要来源。用图B和C装置实验的目的是 。
某工厂产生的铜屑中含有少最铁屑.现要回收利用其中的铜,需除去其中的铁屑,张山同学设计了甲、乙两个实验方案:
(1)以上两个实验方案中,从回收利用率角度考虑,你愿意选择。
(2)两个方案中都有过滤操作,该操作中必须用到的玻璃仪器有
(3)写出两个实验方案中有关反应的化学方程式:
方案甲
方案乙
(4)你能否再设计一个不同原理的方案?写出你的方案
某校同学以“比较锰、铁、铜3种金属的活动性”为课题进行探究。提供的药品:铁片、铜片、锰片、稀盐酸、硫酸亚铁溶液、硫酸铜溶液、硫酸锰溶液。
【做出猜想】他们考虑到铁的活动性比铜强,对3种金属的活动性顺序作出如下猜想。
猜想一:锰>铁>铜;
猜想二:铁>铜>锰;
猜想三:。
【设计实验】为了验证猜想成立,同学们分成三组,分别针对一种猜想设计实验方案。
(1)第一组验证猜想一。实验方案是将锰片、铁片分别放入稀盐酸中,观察现象。
(2)第二组验证猜想二。实验方案是将锰片放入中,观察现象。
(3)第三组验证猜想三。实验方案是(只用两个实验):
。
【实验及结论】各组通过实验和交流,确认猜想一是正确的。第一组同学的实验现象是:。
【拓展研究】随后同学们对探究金属活动性的方案涉及作了进一步研究。
为了验证甲、乙、丙、丁4种金属的活动性依次减弱,某同学设计了如下方案:①把甲放入乙的盐溶液中;②把乙放入丙的盐溶液中;③把乙放入丁的盐溶液中;④把丁放入丙的盐溶液中。你认为哪个实验没有必要做?请说明理由。
。