在一固定容积的密闭容器中进行着如下反应:
CO2(g) + H2(g) 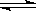 CO(g) + H2O(g) 其平衡常数K和温度t的关系如下:
CO(g) + H2O(g) 其平衡常数K和温度t的关系如下:
| t℃ |
700 |
800 |
850 |
1000 |
1200 |
| K |
2.6 |
1.7 |
1.0 |
0.9 |
0.6 |
(1) K的表达式为: ;
(2) 该反应的正反应为 反应(“吸热”或“放热”);
(3)下列选项中可作为该反应在850℃时已经达到化学平衡状态的标志的是:
A.容器中压强不再变化 B.混合气体中CO浓度不再变化
C.混合气体的密度不再变化 D.c(CO2) =" c(CO)=" c(H2) = c(H2O)
(4)当温度为850℃,某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
| CO |
H2O |
CO2 |
H2 |
| 0.5 mol |
8.5 mol |
2.0 mol |
2.0 mol |
 此时上述的反应中正、逆反应速率的关系式是 (填代号)。
此时上述的反应中正、逆反应速率的关系式是 (填代号)。
a.v(正)>v(逆) b.v(正)<v(逆) c.v(正)=v(逆) d.无法判断
25℃时,某化学兴趣小组在测定酸碱中和滴定曲线的活动中,从实验室领取一瓶一元酸(HA)和一瓶pH=11的碱(BOH)溶液。由于标签破损不知道是何种酸,经测得该酸溶液的pH=3。为了进一步认识该酸,请你参与该兴趣小组的同学设计实验方案。
(1)证明该一元酸是不是盐酸。(简要写出所用试剂、步骤及现象和结论)
。
(2)探究HA是强酸还是弱酸:取上述HA和BOH的溶液各20mL混合后溶液的pH=5,试推测HA是强酸还是弱酸。你的结论是,理由是。
(3)若HA是强酸、BOH是强碱,现将此HA溶液和BOH溶液按一定体积比混合后测得溶液的pH=4(设混合后溶液的体积变化忽略不计)。则混合时酸和碱的体积之比为V(HA):V(BOH)=。
(I)一定温度下,向Na2CO3溶液中加入BaCl2和K2SO4,当两种沉淀共存时,
C(CO32-)/C(SO42-)=。[已知KspBaSO4=1.3ⅹ10-10,KspBaCO3=2.6ⅹ10-9]
(II)联氨(N2H4)及其衍生物是一类重要的火箭燃料,N2H4与N2O4反应能放出大量的热。
(1)已知:2NO2(g) N2O4(g) H =-57.20 kJ·mol-1。一定温度下,在密闭容器中反应2NO2(g)
N2O4(g) H =-57.20 kJ·mol-1。一定温度下,在密闭容器中反应2NO2(g) N2O4(g)达到平衡。其它条件不变时,下列措施能提高NO2转化率的是。
N2O4(g)达到平衡。其它条件不变时,下列措施能提高NO2转化率的是。
| A.减小NO2的浓度 | B.降低温度 | C.增加NO2的浓度 | D.升高温度 |
(2)25 ℃时,1.00 g N2H4(l)与足量N2O4(l)完全反应生成N2(g)和H2O(l),放出19.14 kJ的热量。则反应2N2H4(l)+N2O4(l) = 3N2(g)+4H2O(l)的H =kJ·mol-1。
(3) 17 ℃、1.01×105 Pa,密闭容器中N2O4和NO2的混合气体达到平衡时,
c(NO2) =" 0.0300" mol·L-1、c(N2O4) =" 0.0120" mol·L-1。 则反应2NO2(g) N2O4(g)的
N2O4(g)的
平衡常数K =。
(4)现用一定量的Cu与足量的浓HNO3反应,制得1.00 L已达到平衡的N2O4和NO2混合气体(17 ℃、1.01×105 Pa),理论上至少需消耗Cu克。
某溶液X中含有H+、Ba2+、Al3+、NH4+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO3-中的几种(除此以外,无其他大量存在的离子),针对该溶液进行实验,内容如下:
①用洁净的玻璃棒蘸取少量X溶液,点在pH试纸上,试纸显红色;
②取适量X溶液,加入过量的Ba(NO3)2溶液,得澄清透明的溶液A,并放出一种无色无味的气体B;
③向溶液A中加入过量的NaOH溶液,微热,放出一种有刺激性气味的气体C,同时生成红褐色沉淀D,过滤得到溶液F;
④向F溶液中通入过量的CO2,有白色沉淀生成。
请回答:
(1)C、D的化学式分别为:C 、D。
(2)步骤②中反应的离子方程式为:;
步骤④中反应的离子方程式为:。
(3)X溶液中一定含有的离子是:,不能确定是否含有的离子是,
若要确定该离子(若不止一种,可任选一种)是否存在,可靠的化学方法是。
2007年10月7日CCTV-新闻频道《每周质量报告》,营养专家吴晓松说,味精和鸡精的主要成份都是谷氨酸钠,两者所含的成份差异不足10%。以下为谷氨酸钠的结构简式:

(1)写出谷氨酸钠含氧基团的名称▲;
(2)下列关于谷氨酸钠的说法不正确的是▲。(选填下列选项的编号字母)
| A.谷氨酸钠是一种氨基酸 | B.谷氨酸钠难溶于水 |
| C.谷氨酸钠能与碳酸钠发生反应 | D.谷氨酸钠的分子式为C5H8O4NNa |
已知A、D为单质,B、C为化合物,B溶液中滴加硫氰化钾溶液变红色,A的水溶液能使有色布条褪色。
(1)写出A、C的化学式:A▲;C▲;
(2) B与D反应的离子方程式▲。