在宏观、微观和符号之间建立联系及构建微观粒子模型是化学学科的特点.
(1)在水、铜和氯化钠3种物质中,由分子构成的是 ;
(2)食醋中含有醋酸(CH3COOH).醋酸由 种元素组成,其中碳元素的质量分数为 .
(3)A、B、C、D表示四种物质,其微观示意图见下表.A和B在点燃的条件下反应生成C和D,其化学方程式为: ,若16gB参加反应,则生成D的质量为 g.
| 物质 |
A |
B |
C |
D |
 ﹣﹣氢原子 ﹣﹣氢原子 ﹣﹣氧原子 ﹣﹣氧原子 ﹣﹣硫原子 ﹣﹣硫原子 |
| 微观示意图 |
 |
 |
 |
 |
写出下列反应的文字表达式:
(1)木炭在氧气中燃烧:
(2)红磷在氧气中燃烧:
(3)加热氯酸钾制取氧气:
准确取用少量液体物质除要量筒外,还需要的仪器有;用烧杯加热液体物质时,为使其均匀受热,烧杯应放在上加热;小明同学用托盘天平称了5.4 g NaCl(1 g以下用游码),结果老师检查发现他把药品和砝码的位置颠倒了,他称得NaCl的实际质量为g。
用适当的数字和符号填写:
(1)2个氢原子(2)钙元素
(3)地壳中含量最高的金属元素
请你与小明一起进行实验室制取二氧化碳的研究
(1) 选择药品 。小明对三组药品进行了研究,实验记录如下:
| 组别 |
药品 |
实验现象 |
| ① |
块状石灰石和稀盐酸 |
产生气泡速率适中 |
| ② |
块状石灰石和稀硫酸 |
产生气泡速率缓慢并逐渐停止 |
| ③ |
碳酸钠粉末和稀盐酸 |
产生气泡速率很快 |
从制取和收集的角度分析,一般选第①组药品,该组药品发生反应的文字表达式为
;不选择第③组药品的原因是
(2) 选择装置。他认为能选择用过氧化氢制氧气的发生装置。你认为他选择气体发生装置的依据是
(3) 制取气体。将药品装入所选装置制取气体,他认为只能用向上排空气法收集,是因为
(4) 气体检验。将生成的气体通入石蕊中,石蕊变红。原因是(用反应的文字表达式表示)。由此实验他确定该气体一定是二氧化碳。他的检验方法是否正确?请说明理由
(5) 提供简易装置完成二氧化碳的制取、收集和验满。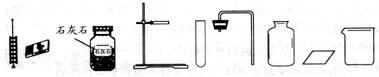
上图是实验桌上摆放好的该实验所需用品,小明发现缺少一种实验仪器和一种药品,仪器名称;药品名称
(6) 上图是小明实验的主要步骤,这些步骤的正确顺序是(填字母序号,下同),其中操作有误的是
(7) 如果在实验过程中要向试管中添加酸溶液,要求不改变实验装置,可选用来完成。
(8) 如果要用上述仪器完成用高锰酸钾制取氧气,还需增加的玻璃仪器是
文字表达式
(9) 用如右图所示装置收集二氧化碳,则应该从端
通入二氧化碳(填字母序号)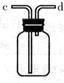
实验室完成过滤所需实验仪器有,过滤的操作注意点中“一贴”是指,“一贴”的具体做法是
过滤后所得滤液仍然浑浊的可能原因是