(10分)第一电离能I1是指气态原子X(g)处于基态时,失去一个电子成为气态阳离子X+(g)所需的能量。下图是部分元素原子的第一电离能I1随原子序数变化的曲线图(其中12号至17号元素的有关数据缺失)。
请回答以下问题:
(1)认真分析上图中同周期元素第一电离能的变化规律,推断Na~Ar元素中,Al的第一电离能的大小(最小)范围为________<Al<________(填元素符号)。
(2)从上图分析可知,同一主族元素原子的第一电离能I1变化规律是________。
(3)上图中第一电离能最小的元素在周期表中的位置是________。
(4)根据对角线规则,Be、Al元素最高氧化物的水化物性质相似,它们都具有________,
工业上金属的冶炼过程复杂。
(1)炼铁涉及的2个热化学方程式:
Fe2O2(s)+1/3CO(g)=2/3Fe3O4(s)+1/3CO2(g)△H=-15.73kJ•mol-1
Fe3O4+CO(g)=3FeO(s)+CO2(g)△H=+640.4kJ•mol-1
则反应Fe2O3(s)+CO(g)=2FeO(s)+CO2(g)的△H=__________;
(2)工业上电解硫酸锌溶液可实现湿法炼锌(控制条件,使H+难放电、阳极电极不溶解).写出电解总反应离子方程式____________________;
(3)将干净的铁片浸于熔融的液态锌水中可制得镀锌钢板,这种钢板具有很强的耐腐蚀能力。镀锌钢板的镀层一旦被破坏后,锌将作为原电池的___极发生___反应。(填“氧化”或“还原”)
(4)实验室用镀锌钢板与稀硫酸制取标准状况下的氢气4.48L,则该反应转移的电子数为______,消耗硫酸的物质的量是_____________。
已知A、B、C、D四种短周期元素原子序数依次增大,A与D的原子序数之和等于B与C的原子序数之和,由D元素组成的单质在通常状况下呈黄绿色,B、C、D三种元素位于同一周期,B、C、D三种元素的最高价氧化物对应的水化物分别为X、Y、Z,且X、Y、Z可两两相互反应生成盐和水,试推断并用相应的化学用语回答下列问题:
(1)D元素原子的结构示意图为_________________;
(2)X与C元素的最高价氧化物可以发生反应,该反应的离子方程式为___________________;
(3)A、B、C三种元素的原子半径由小到大的顺序为__________________________;
(4)A与D两元素的气态氢化物之间可以反应生成一种盐,该盐的水溶液呈___(填“酸”、“碱”或“中”)性,该水溶液中各离子浓度由小到大的顺序为_____________________。
为探究铁质材料与热浓硝酸的反应,某学习小组进行了以下实验:
[探究一]
(1)铁钉放在浓硫酸中浸泡后,再用蒸馏水冲洗,然后放入硫酸铜溶液中,铁钉表面无明显变化,其原因是_____________________。
(2)另称取铁钉6.0g放入15.0ml浓硝酸中,加热,充分应后得到溶液M并收集到气体N。为了探究溶液M中铁元素的价态,甲同学设计了如下实验:
有药品:
| A.稀盐酸溶液 |
| B.稀硫酸溶液 |
| C.淀粉KI溶液 |
| D.KMnO4溶液 |
E.NaOH溶液
F.H2O2溶液
G.KSCN溶液
仪器:试管和滴管
步骤1.取试样,滴加少量的______(填试剂字母),溶液的颜色变____色,则试样中含有Fe3+,发生反应的离子方程式为________________。
步骤2.再去适量的试样滴加少量的______(填试剂字母),若溶液_______,则试样中含有Fe2+。
[探究二]
乙同学设计以下装置探究气体N的成分。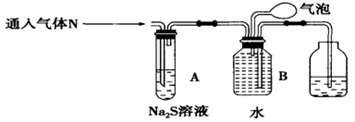
(3)A装置的作用:______________________。
(4)B装置收集满气体后,通过气泡鼓入空气后,有红棕色气体生成,能否确定气体N中含NO____(填“能”或“不能”)?理由是________________。
聚苯乙烯可用于制备高频绝缘材料,苯乙烯在一定条件下存在如下图转化关系。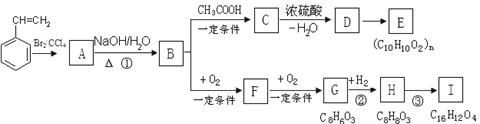
请回答下列问题:
(1)由苯乙烯合成这种高聚物的化学方程式为。
(2)反应①的反应类型是,C→D的反应类型是。
(3)C可能的结构简式有。
(4)H有多种同分异构体。同时符合下列条件的同分异构体共有种。
a.与FeCl3溶液发生显色反应
b.1 mol H最多能与3 mol NaOH反应;
c.苯环上只有两个取代基。
(5)反应③的化学方程式是。
快乐是什么?精神病学专家通过实验发现:在大脑的相应部位—-“奖赏中心”,给予柔和的电击,便会使大脑处于极度快乐的状态。人们已经将“奖赏中心”各部分的脑电图绘制出来,并认为,在各区域之间传递信息的化学物质是多巴胺,所以“奖赏中心”又称为多巴胺系统。多巴胺结构如下图: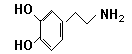
(1)试判断多巴胺能发生的化学反应。
| A.加成 | B.消去 | C.氧化 | D.水解 |
(2)写出与多巴胺互为同分异构体且属于1,3,5-三取代苯并且苯环上直接连有一个羟基和一个氨基且分别能与钠和氢氧化钠反应,消耗钠与氢氧化钠的物质的量之比为2:1的所有物质的结构简式:
。
(3)多巴胺可由香兰素与硝基甲烷缩合,再经锌-盐酸还原水解而得。合成过程表示如下: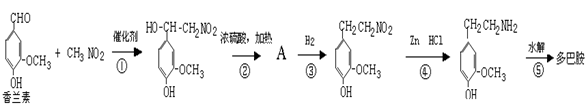
请写出②、⑤两步的化学方程式:
②:
⑤: