在A、B、C、D四种元素中,A为地壳这含量最多的元素;B的单质在气体中密度最小;C元素的原子失去两个电子后,其电子层结构和氩原子相同;D元素的原子核外有三个能层,各能层电子数之比为1:4:1。
(1)写出上述四种元素的名称:A 、B 、C 、
(2)写出C2+离子的电子排布式
(3)指出A、B、C三种元素中所形成的化合物中所包含化学键的类型
A和B反应生成C,假定反应由A、B开始,它们的起始浓度均为1mol/L。反应进行2min后A的浓度为0.8mol/L,B的浓度为0.6mol/L,C的浓度为0.6mol/L。则2min内反应的平均速率υA=__________,υB=_____________,υC=___________。该反应的化学反应方程式为 。
如图所示,合成氨反应:N2(g)+3H2(g) 2NH3(g)△H<0。在某一时间段t0~t6中反应速率与反应过程的曲线图。试回答下
2NH3(g)△H<0。在某一时间段t0~t6中反应速率与反应过程的曲线图。试回答下
列问题:
⑴合成氨反应已达平衡状态的时间段为:。
⑵t1~t2时间段是改变的条件使平衡向方向移动;t4~t5时间段是改变的条件使平衡向方向移动。
⑶在此过程中,氨的百分含量最高的一段时间是。
在某温度下,A+B 2C反应达到化学平衡。
2C反应达到化学平衡。
(1)升高温度时,C的物质的量浓度减小,则正反应是 热反应,υ(正) ,
υ(逆) (“减慢”或“加快”),平衡向 移动。
(2)若B为气态,增大压强平衡不发生移动,则A是 态,C是 态。
(3)若增减B的量,平衡不发生移动,则B是 态。
将等物质的量的H2和I2(g)加入密闭容器中进行反应:H2+I2(g)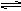 2HI,反应进行到2min时测得反应速率υ(HI)=0.1mol/(L·min),I2(g)的物质的量浓度为0.4mol/L。
2HI,反应进行到2min时测得反应速率υ(HI)=0.1mol/(L·min),I2(g)的物质的量浓度为0.4mol/L。
(1)反应速率υ(H2)= ,υ(I2)= 。
(2)2min未[HI]= mol/L。
(3)起始时,[H2]= mol/L,[I2]= mol/L。
)在一定体积的密闭容器中,进行如下化学方程式:CO(g)+H2O(g)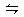 CO2(g)+H2(g),其化学平衡常数K和温度t的关系如下表:
CO2(g)+H2(g),其化学平衡常数K和温度t的关系如下表:
| t℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.5 |
回答下列问题:
⑴该反应化学平衡常数的表达式为K=。
⑵该反应为(填“放热”或“吸热”)反应。
⑶能判断该反应是否达到化学平衡状态的依据是。
| A.容器中压强不变 | B.混合气体中c(CO)不变 |
| C.υ(正,H2)=υ(逆,H2O) | D.c(CO2)=c(CO) |
⑷某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O)。试判断此时的温度为℃。