某可逆反应在0—2分钟的进行过程中, 在不同反应时间各物质的量的变化情况如右图所示。则该反应的反应物是 ,生成物是 ,此反应 (填“是”或“不是”)可逆反应;反应开始至2分钟时, (填“能”或“不能”)用C表示反应速率,2分钟后A、B、C各物质的量不再随时间的变化而变化,说明在这个条件下,反应已达到了 状态,此时正反应速率 (填 “等于”或“不等于”) 逆反应速率。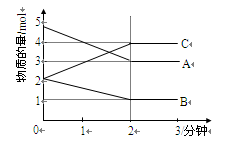
Ⅰ.重铬酸钾是工业生产和实验室的重要氧化剂,重铬酸钾的溶解度随温度影响较大。工业上常用铬铁矿(主要成分为FeO·Cr2O3,杂质为SiO2、Al2O3)为原料生产它,实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下图。涉及的主要反应是:
6FeO·Cr2O3+24NaOH+7KClO3=12Na2CrO4+3Fe2O3+7KCl+12H2O
(1)碱浸前将铬铁矿粉碎的作用是。
(2)步骤③调节pH后过滤得到的滤渣是。
(3)操作④中,酸化时,CrO42-转化为Cr2O72-,写出平衡转化的离子方程式。
(4)用简要的文字说明操作⑤加入KC1的原因。
(5)称取重铬酸钾试样2.500g配成250mL溶液,取出25mL于锥形瓶中,加入10mL 2mol/ LH2SO4和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min。然后加入100mL水,加入3mL淀粉指示剂,用0.1200 mol/LNa2S2O3标准溶液滴定(I2+2S2O32-=2I一十S4O52-)
判断达到滴定终点的依据是。
Ⅱ.氨作为一种富氢化合物,具有各种优点,特别是氨有着良好的产业基础,价格低廉,氨作为燃料电池燃料具有很大的发展潜力。氨氧燃料电池示意图,回答下列问题
(1) a电极的电极反应式为_________________________;
(2)反应一段时间后,电解质溶液的pH将_________
(填“增大”“减小”或“不变”);
(3)已知:①N2(g)+3H2(g)=2NH3(g) △H="-92.4" kJ/mol,
②2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ/mol,
试写出氨气完全燃烧生成气态水的热化学方程式:________________________;
(14分)工业上为了测定辉铜矿(主要成分是Cu2S)中Cu2S的质量分数,设计了如图装置。实验时按如下步骤操作:
| A.连接全部仪器,使其成为如图装置,并检查装置的气密性。 |
| B.称取研细的辉铜矿样品1.000g。 |
| C.将称量好的样品小心地放入硬质玻璃管中。 |
| D.以每分钟1L的速率鼓入空气。 |
E.将硬质玻璃管中的辉铜矿样品加热到一定温度,发生反应为:Cu2S+O2=SO2 +2Cu。
F.移取25.00ml含SO2的水溶液于250ml锥形瓶中,用0.0100mol/L KMnO4标准溶液滴定至终点。按上述操作方法重复滴定2—3次。
试回答下列问题:
(1)装置①的作用是_________________;装置②的作用是____________________。
(2)假定辉铜矿中的硫全部转化为SO2,并且全部被水吸收,则操作F中所发生反应的化学方程式为
(3)若操作F的滴定结果如下表所示,则辉铜矿样品中Cu2S的质量分数是_________。
| 滴定次数 |
待测溶液的体积/mL |
标准溶液的体积 |
|
| 滴定前刻度/mL |
滴定后刻度/mL |
||
| 1 |
25.00 |
1.04 |
21.03 |
| 2 |
25.00 |
1.98 |
21.99 |
| 3 |
25.00 |
3.20 |
21.24 |
(4)本方案设计中有一个明显的缺陷影响了测定结果(不属于操作失误),你认为是(写一种即可)。
(5)已知在常温下FeS 的 Ksp= 6.25 × 10 -18, H2S 饱和溶液中 c (H+)与 c (S2-)之间存在如下关系: c2 (H+) ·c(S2-) = 1.0×10-22。在该温度下,将适量 FeS 投入硫化氢饱和溶液中,欲使溶液中(Fe2+)为 lmol/L,应调节溶液的c(H十)为__________________。
(6)某人设想以右图所示装置用电化学原理生产硫酸,写出通入SO2的电极的电极反应式______.
氧氮杂环是新药研制过程中发现的一类重要活性物质,具有抗惊厥、抗肿瘤、改 善脑缺血等性质。下面是某研究小组提出的一种氧氮杂环类化合物H的合成路线:
(1)原料A的同分异构体中,含有苯环、且核磁共振氢谱中有4个峰的是____(写出其结构简式)。
(2) 反应③的反应类型是______,原料D中的含氧官能团名称是____________。
(3)反应②的化学方程式是______________________________。
(4)原料B俗名“马来酐”,它是马来酸(顺丁烯二酸: )的酸酐,它可以经下列变化分别得到苹果酸(
)的酸酐,它可以经下列变化分别得到苹果酸( )
)
写出反应I化学方程式_____________
生活中常用的某种香料X的结构简式为
已知:

香料X的合成路线如下:
(1)A的结构简式是_________________________
(2)检验有机物C中含有碳碳双键所需用的试剂__________________。
A.银氨溶液 B.酸性高锰酸钾溶液 C.溴水 D.氢氧化钠溶液
(3)D→X的化学方程式为________________________________________。
(4)有机物B的某种同分异构体E,具有如下性质:
A.与浓溴水反应生成白色沉淀,且1 mol E最多能与4 mol Br2反应
B.红外光谱显示该有机物中存在碳碳双键,则E的结构简式为_______。
某学习小组探究溴乙烷的消去反应并验证产物。
实验原理:CH3CH2Br + NaOH  CH2=CH2↑ + NaBr + H2O
CH2=CH2↑ + NaBr + H2O
实验过程:组装如图1所示装置,
检查装置气密性,向烧瓶中注入10mL溴乙烷和15mL饱和氢氧化钠乙醇溶液,微热,观察实验现象。一段时间后,观察到酸性KMnO4溶液颜色褪去。
(1)甲同学认为酸性KMnO4溶液颜色褪去说明溴乙烷发生了消去反应,生成了乙烯;而乙同学却认为甲同学的说法不严谨,请说明原因:。
(2)丙同学认为只要对实验装置进行适当改进,即可避免对乙烯气体检验的干扰,改进方法:。
改进实验装置后,再次进行实验,却又发现小试管中溶液颜色褪色不明显。该小组再次查阅资料,对实验进行进一步的改进。
资料一:溴乙烷于55℃时,在饱和氢氧化钠的乙醇溶液中发生取代反应的产物的百分比为99%,而消去反应产物仅为1%。
资料二:溴乙烷发生消去反应比较适宜的反应温度为90℃~110℃,在该范围,温度越高,产生乙烯的速率越快。
资料三:溴乙烷的沸点:38.2℃。
(3)结合资料一、二可知,丙同学改进实验装置后,溶液颜色褪色不明显的原因可能是,此时发生反应的化学方程式为: 。
(4)结合资料二、三,你认为还应该在实验装置中增加的两种仪器是①。 ②。