某中学化学实验小组为了证明和比较SO2与氯水的漂白性,设计了如下装置:
(1)实验室常用装置E制备Cl2,指出该反应中浓盐酸所表现出的性质______、_______。
(2)反应开始后,发现B、D两个试管中的品红溶液都褪色,停止通气后,给B、D两个试管加热,两个试管中的现象分别为:
B ,
D 。
(3)装置C的作用是 。
(4)该实验小组的甲、乙两位同学利用上述两发生装置按下图装置继续进行实验:
通气一段时间后,甲同学实验过程中品红溶液几乎不褪色,而乙同学的实验现象是品红溶液随时间的推移变得越来越浅。试根据该实验装置和两名同学的实验结果回答问题。
①试分析甲同学实验过程中,品红溶液不褪色的原因是
,
反应的离子方程式是 ;
②你认为乙同学是怎样做到让品红溶液变得越来越浅的?
。
维生素C是一种水溶性维生素,结构如下图所示:
它的化学式为__________。人体缺乏维生素C易得坏血症,所以维生素C又称__________。在维生素C溶液中滴加紫色石蕊试液,溶液变红色,说明维生素C溶液具有__________性;在维生素C溶液中滴加少量蓝色的含淀粉的碘水,可观察到的现象是__________,说明维生素C具有__________性。
某种豆类作物中所含的天然蛋白质在酶的作用下发生水解,可得到甲、乙两种氨基酸。已知甲的结构简式为: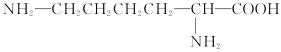 ,乙的分子式为C4H7O4N。
,乙的分子式为C4H7O4N。
(1)由甲形成的三肽中氨基、羧基的数目依次为__________、__________。
(2)若乙不能发生银镜反应,其分子中没有甲基,则乙的结构简式为____________________。
(3)乙的分子中的—NH2和—COOH发生分子内缩合反应脱去一分子水,所形成的含有四元环结构的化合物的结构简式为____________________。
由人尿分离出来的结晶化合物A,熔点为187~188 ℃。对化合物A做下列实验:
(1)测得A的蒸气密度为8.000 g·L-1(已折合成标准状况),取17.92 g A完全燃烧,生成的气体通过浓硫酸,浓硫酸增重8.100 g。剩余气体通过碱石灰,气体质量减轻39.60 g;另取17.92 gA完全分解,可得标准状况下氮气1.120L,试通过计算确定A的化学式。
(2)又知A和足量6 mol·L-1的盐酸混合加热可以完全水解,1 molA水解生成1 mol B和1 mol C。已知A、B、C三物质分子中均含有一个羧基;B物质仅由碳、氢、氧三种元素组成,其物质的量之比为7∶6∶2;C俗名为甘氨酸。写出A、B、C的结构简式。A__________,B__________,C__________。
现拟在实验室里利用空气和镁粉为原料制取少量氮化镁(Mg3N2)。已知实验中可能会发生下列反应: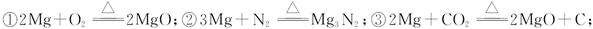

可供选择的装置和药品如下图所示(镁粉、还原铁粉均已干燥,装置内所发生的反应是完全的,整套装置的末端与干燥管相连)。
回答下列问题:
(1)在设计实验方案时,除装置A、E外,还应选择的装置(填字母代号)及其目的分别是________________________________________________________________________________
_______________________________________________________________________________。
(2)连接并检查实验装置的气密性。实验开始时,打开自来水的开关,将空气从5升的储气瓶压入反应装置,则气流流经导管的顺序是(填字母代号)______________________________。
(3)通气后,如果同时点燃A、F装置的酒精灯,对实验结果有何影响? __________,原因是_____________________________________________________________________________。
(4)请设计一个实验,验证产物是氮化镁:________________________________________
_______________________________________________________________________________。
有如下图所示六组制取漂白粉的装置,请依据题意回答问题。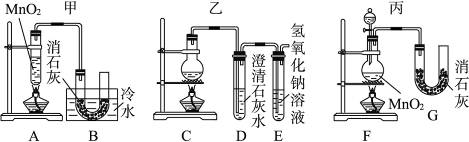
(1)有下列几项优缺点:a.不容易控制反应速率;b.容易控制反应速率;c.有副反应发生;d.可防止副反应发生;e.污染环境;f.可防止污染环境。请对上图所示的甲、乙、丙三套装置的优缺点作出评析,选择符合题目要求的选项填在下列空格内。
| 优点 |
缺点 |
|
| ①甲装置 |
||
| ②乙装置 |
||
| ③丙装置 |
(2)上图所示装置中,甲由A、B两部分组成;乙由C、D、E三部分组成;丙由F、G两部分组成。请从图A~G各部分装置中选取合理的组成部分,组装成一套较完善的实验装置,装置的连接顺序(按气流从左到右的方向)是__________。
(3)实验中若用100 mL 12 mol·L-1的浓盐酸与足量的MnO2反应,最终生成Ca(ClO)2的物质的量总是__________(填“大于”“小于”或“等于”)0.15 mol,其原因是(假定各步反应均无反应物损耗,且用无副反应发生)________________________________________。