掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。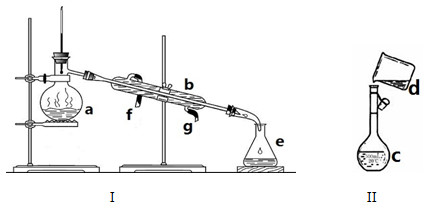
⑴写出下列仪器的名称:
a、 b、 c、
⑵仪器a~e中,使用前必须检查是否漏水的有 (填字母)
⑶若利用装置I分离四氯化碳和酒精的混合物,还缺少的仪器是 ,将仪器补充完整后进行实验,温度计水银球的位置在 处,冷凝水由 (填f或g)口通入, 由 口流出。
(4)现需配制0.1mol/LNaOH溶液450mL,装置II是某同学转移溶液的示意图。
①图中的错误是 ,除了图中给出的的仪器和托盘天平、药匙外,为完成实验还必须使用的仪器有: ;
②根据计算得知,所需NaOH的质量为 g;
③配制时,其正确的操作顺序是(用字母表示,每个字母只能使用一次) ________
| A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶 |
| B.准确称取计算量的氢氧化钠固体于烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解 |
| C.将溶解的氢氧化钠溶液沿玻璃棒注入500mL的容量瓶中 |
| D.将容量瓶盖紧,振荡,摇匀 |
E.改用胶头滴管加水,使溶液凹液面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线1~2cm处
④若俯视容量瓶刻度,对所配制溶液浓度的影响是________(填“偏低”“偏高”或“无影响”)
(1)写出实验室由苯和浓硝酸反应制取硝基苯的化学方程式:.
该反应属于反应。
(2)如图所示的实验装置图中存在哪些错误?请指正。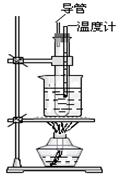
①;
②;
③。
(3)在试管中将两种浓酸混和的操作方法是
(4)试简述水浴加热的优点。
某学生用0.1 mol/L的KOH标准溶液滴定未知浓度盐酸,其操作分解为如下几步:
| A.移取20 mL待测盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞 |
| B.用标准溶液润洗滴定管2~3次 |
| C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液 |
| D.取标准KOH溶液注入碱式滴定管至0刻度以上2-3 cm |
E.调节液面至0或0以下刻度,记下读数
F.把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点并记下滴定管液面的刻度。
就此实验完成填空
(1)正确操作步骤的顺序是(用序号字母填写)____________________________;
(2)上述B步骤操作的目的是________________________________________________;
(3)上述A步骤操作之前,先用待测液润洗锥形瓶,则对滴定结果的影响是________;
(4)判断到达滴定终点的实验现象是_____________________________________;
(5)若称取一定量的KOH固体(含少量NaOH)配制标准溶液并用来滴定上述盐酸则对滴定结果产生的影响是____________________________________。
 某探究
某探究 小组同学用金属铝分别与稀盐酸或稀硫酸反应的方法研究金属与不同酸反应的差异及影响反应速率的因素。
小组同学用金属铝分别与稀盐酸或稀硫酸反应的方法研究金属与不同酸反应的差异及影响反应速率的因素。
实验药品:2. 0moL/L 盐酸、4. 0mol/L盐酸、2 .0mol/L硫酸、4.0mol/L硫酸,质量和相同的铝片和铝粉(金属表面氧化膜都已除去);每次实验各种酸的用量均为50. 0mL,金属
盐酸、4. 0mol/L盐酸、2 .0mol/L硫酸、4.0mol/L硫酸,质量和相同的铝片和铝粉(金属表面氧化膜都已除去);每次实验各种酸的用量均为50. 0mL,金属 用量均为9. 0g。
用量均为9. 0g。
(Ⅰ)甲同学用铝片分别和稀盐酸、稀硫酸反应,实验及其现象如下:
| 反应进程(分钟) |
1 |
2 |
5 |
15 |
20 |
| 4.0mol/L盐酸 |
少量气泡 |
较多气泡 |
大量气泡 |
反应剧烈 |
反应结束 |
| 2.0mol/L硫酸 |
无明显现象 |
极少量气泡 |
少量气泡 |
||
| 4.0mol/L硫酸 |
无明显现象 |
少量气泡 |
有比 较连续的气泡 较连续的气泡 |
请回答:
(1)写出铝与盐酸反应的离子方程式。
(2)反应1~15min内,铝与盐酸的反应速率逐渐加快,其原因是
。
(3)以上探究铝与稀盐酸、稀硫酸反应速率有差异,你认为其原因有哪些可能?请提出 你的假设(写出2种可能):。
你的假设(写出2种可能):。
(Ⅱ)(1)乙同学设计了如下影响反应速率因素的实验(温度控制为25℃和35℃)。请你根据实验目的帮助该同学完成以下实验设计表(用量:酸均为50. 0mL、铝为9. 0g过量):
| 实验目的 |
实验 编号 |
温度 |
金属铝 形态 |
盐酸浓度 /mol·L-1 |
| 1. 实验①和②探究盐酸浓度对该反应速率的影响; 2. 实验①和③探究温度对该反应速率的影响; 3. 实验①和④探究金属规格(铝片、铝粉)对该反应速率的影响。 |
① |
25˚ C C |
铝 |
4. 0 |
| ② |
||||
| ③ |
||||
| ④ |
某化学实验小组用如图所示的装置制取乙酸乙酯,并检验乙酸乙酯中是否含有乙酸杂质(铁架台、夹子等支撑仪器省略)。已知乙酸乙酯的沸点为77.1℃,乙醇沸点为78.4℃,乙酸的沸点为118℃。请根据要求填空:
⑴写出实验室用冰醋酸和无水乙醇制乙酸乙酯的化学方程式:
__________________。
⑵为使反应物充分反应,以下措施中正确的是(填写对应序号)。
①先小火温热,再慢慢升温至微沸状态②先大火加热至沸腾状态,并持续加热保持沸腾状态③使用稀硫酸作催化剂④作用浓硫酸作催化剂
⑶如果单孔塞上的导管短一些,对乙酸乙酯的收集有何影响,简述原因。
答:。
⑷A同学将收集到的乙酸乙酯滴入含有少量酚酞的NaOH溶液中并在水浴中温热,发现溶液的红色逐渐变浅,由此得出乙酸乙酯中含有乙酸的结论,你认为这一结论正确吗?为什么?
答:。
⑸B同学将收集到的乙酸乙酯滴入饱和NaHCO3溶液中,观察到有少量气泡产生,可得出的结论是,该过程中发生反应的化学方程式是。
⑹C同学将收集到的乙酸乙酯缓缓滴入饱和Na2CO3溶液中,无气泡产生,于是得出该乙酸乙酯中不含乙酸的结论。请你运用所学知识,评价该同学的结论是否正确。
我的评价是:。
CuSO4·5H2O是铜的重要化合物,有着广泛的应用。以下是CuSO4·5H2O的实验室制备流程图。
根据题意完成下列填空:
(1)向含铜粉的稀硫酸中滴加浓硝酸,在铜粉溶解时可以观察到的实验现象:、。
(2)如果铜粉、硫酸及硝酸都比较纯净,则制得的CuSO4·5H2O中可能存在的杂质是,除去这种杂质的实验操作称为。
(3)已知:CuSO4+2NaOH=Cu(OH)2↓+ Na2SO4
称取0.1000 g提纯后的CuSO4·5H2O试样于锥形瓶中,加入0.1000 mol/L氢氧化钠溶液28.00 mL,反应完全后,过量的氢氧化钠用0.1000 mol/L盐酸滴定至终点,耗用盐酸20.16 mL,则0.1000 g该试样中含CuSO4·5H2O g。
(4)上述滴定中,滴定管在注入盐酸之前,先用蒸馏水洗净,再用。
在滴定中,准确读数应该是滴定管上蓝线所对应的刻度。
(5)如果采用重量法测定CuSO4·5H2O的含量,完成下列步骤:
①②加水溶解③加氯化钡溶液,沉淀④过滤(其余步骤省略)
在过滤前,需要检验是否沉淀完全,其操作是
(6)如果1.040 g提纯后的试样中含CuSO4·5H2O的准确值为1.015 g,而实验测定结果是l.000 g 测定的相对误差为。