向2L密闭容器中通入amol 气体 A和bmol气体B,在一定条件下发生反应:
xA(g)+ yB(g) pC(g) + qD(g)。已知:平均反应速率V(C) =1/2V(A) ;反应2min 时,A的浓度减少了1/3 ,B的物质的量减少了a/2 mol,有a mol D生成。回答下列问题:
pC(g) + qD(g)。已知:平均反应速率V(C) =1/2V(A) ;反应2min 时,A的浓度减少了1/3 ,B的物质的量减少了a/2 mol,有a mol D生成。回答下列问题:
(1)反应2min内,A的平均反应速率是 mol•L-1•min-1;
(2)原化学方程式中,化学计量数是:
A(g)+ B(g)  C(g) + D(g)
C(g) + D(g)
(3)反应平衡时,D为2a mol,则B的转化率为 ;
(4)如果只升高反应温度,其他反应条件不变,平衡时D为 1.5a mol,则该反应
的△H 0;(填“>”、“<”或“=”)
(5)如果其他条件不变,将容器的容积变为1L,进行同样的实验,则与上述反应比较:
①反应速率增大 ,理由是体积减小,反应物的浓度增大,因而使反应速率增大;
②平衡时反应物的转化率 (填“增大”、“减小”或“不变”),理由是
原子序数小于36的X、Y、Z、W四种元素,其中X是形成化合物种类最多的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29。回答下列问题:
(1)Y2X2分子中Y原子轨道的杂化类型为,1mol Y2X2含有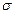 键的数目为。
键的数目为。
(2)化合物ZX3的沸点比化合物YX4的高,其主要原因是。
(3)元素Y的一种氧化物与元素Z的一种氧化物互为等电子体,元素Z的这种氧化物的分子式是。
(4)元素W的一种氯化物晶体的晶胞结构如图所示,该氯化物的化学式是,它可与浓盐酸发生非氧化还原反应,生成配合物HnWCl3,反应的化学方程式为[来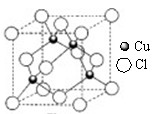
下图是元素周期表的一部分
| ① |
|||||||||||||||||
| ② |
③ |
④ |
⑤ |
||||||||||||||
| ⑥ |
⑦ |
⑧ |
|||||||||||||||
| ⑨ |
⑩ |
(1)写出元素⑩的基态原子的价电子排布式_____________,指出它在周期表中的位置_______________。焊接钢轨时,常利用⑩的某些氧化物与⑦的单质在高温下发生反应,试写出其中一种反应的化学方程式__。
(2)①③⑤三种元素可以形成多种有机化合物分子,其中最简单原子数最少的一种是室内装潢时形成的主要气体污染物。试写出它的电子式__,根据价层电子对互斥(VSEPR)理论推测该分子的空间构型为__。
(3)③④⑤⑥⑧五种元素都可以与元素①形成化合物,其中熔点最高的是________(写化合物的化学式)。如果在温度接近373K时,根据M=m/n测定⑤的气态氢化物的相对分子质量,结果发现测定结果比理论值高,其原因是。
(4)某些不同族元素的性质也有一定的相似性,如上表中元素⑦与元素②的氢氧化物有相似的性质。请写出元素②的氢氧化物与NaOH溶液反应的化学方程式:
。
蛇纹石矿可以看作由MgO、Fe2O3、Al2O3、SiO2组成。由蛇纹石制取碱式碳酸镁的实验步骤如下
| 氢氧化物 |
Fe(OH)3 |
Al(OH)3 |
Mg(OH)2 |
| 开始沉淀pH |
1.5 |
3.3 |
9.4 |
(1)蛇纹石矿加盐酸溶解后,溶液里除了Mg2+外,还含有的金属离子是_____
(2)进行Ⅰ操作时,控制溶液pH=7-8(有关氢氧化物沉淀的pH见上表)
Ca(OH)2不能过量,若Ca(OH)2过量可能会导致_________溶解、_________沉淀。
(3)从沉淀混合物A中提取红色氧化物作颜料,先向沉淀物A中加入_________ (填入物质的化学式),然后__________________________________ (依次填写实验操作名称)。
(4)物质循环使用,能节约资源。上述实验中,可以循环使用的物质是_____________(填写物质化学式)。
(5)高温煅烧碱式碳酸镁得到MgO。取碱式碳酸镁4.66g,高温煅烧至恒重,得到固体2.00g和标准状况下CO20.896L,通过计算确定碱式碳酸镁的化学式。
(6)若热分解不完全,所得碱式碳酸镁中将混有MgCO3,则产品中镁的质量分数(填 “升高”、“降低”或“不变”)。
A、B、C、X均为常见的纯净物,它们之间有如下转化关系(副产品已略去)。
试回答:
(1)若X是强氧化性单质,则A不可能是。
a. S b. N2 c. Na d. Mg e. Al
(2)若X是金属单质,向C的水溶液中滴入AgNO3溶液,产生不溶于稀HNO3的白色沉淀,则B的化学式为;C溶液在贮存时应加入少量X,理由是(用必要的文字和离子方程式表示)。
检验此C溶液中金属元素价态的操作方法是。
(3)若A、B、C为含某金属元素的无机化合物,X为强电解质,A溶液与C溶液反应生成B,则B的化学式为,X的化学式可能为(写出不同类物质)或。
反应①的离子方程式为。
一种无色透明溶液中,可能含有下列离子:K+、Mg2+、Al3+、Fe2+、Ba2+、NO3-、SO42-、HSO3-、HCO3-、I-和Cl-,取该溶液进行如下实验:
①将溶液滴在pH试纸上,呈红色。
②将少许溶液浓缩后加入铜片和硫酸,有无色气体析出,此气体通空气则立即变成红棕色。
③取少许溶液滴入BaCl2试液,则产生白色沉淀。
④取实验③中的澄清溶液,滴入AgNO3试液,产生不溶于稀HNO3的白色沉淀。
⑤另取少许溶液,滴入NaOH溶液,有白色沉淀生成,当NaOH过量时,又有部分白色沉淀溶解。
根据以上现象判断,原溶液中肯定不存在的离子是;肯定存在的离子是;不能作出判断的离子是。