现有NH4Cl和NH3·H2O组成的混合溶液,若其pH=7,则该溶液中c(NH4+)___c(Cl-);若pH>7,则该溶液中c(NH4+)______c(Cl-)。(填“>”、“<”、“=”).
新合成的一种烃,其碳架呈正三棱柱体(每条边等长度)(如图所示)
(1)写出该烃的分子式;
(2)该烃的一氯取代物是否有同分异构体;
(3)该烃的二氯取代物有种。
(每空2分,共10分)依据事实,填空:
(1)已知某条件下可发生如下反应CH3-CH3→CH2=CH2+H2,有关化学键的键能如下:
| 化学键 |
C-H |
C=C |
C-C |
H-H |
| 键能(kJ/mol) |
414.4 |
615.3 |
347.4 |
435.3 |
则该反应的热化学方程式右边的ΔH=;
(2)氢氧燃料电池已用于航天飞机。以30%KOH溶液为电解质的这种电池在使用时的电极反应式:正极:;负极:
(3)某核素AZX的氯化物XCl2 1.11 g配成溶液后,需用1mol·L-1的硝酸银溶液20 ml才能把氯离子完全沉淀下来。则X的质量数为;
(4)将甲烷和氧气的混合气体充入含有23.4 g Na2O2的密闭容器中,保持容器中温度为150 ℃,用电火花引燃充分反应后,压强为0 Pa,若将残留物溶于水,无气体逸出。此过程的总反应方程式为。
(共8分)在恒温恒容的密闭容器中通入1mol N2和Xmol H2发生如下反应:N2+3H2 2NH3。达到平衡后,测得反应放出的热量为18.4kJ,混合气体的物质的量为3.6mol,容器内的压强变为原来的90%。
2NH3。达到平衡后,测得反应放出的热量为18.4kJ,混合气体的物质的量为3.6mol,容器内的压强变为原来的90%。
(1)起始时充入H2的物质的量为mol,氢气的转化率为;
(2)该反应的热化学方程式为;
(3)若起始时加入N2、H2、NH3的物质的量分别为a、b、c,达到平衡时各组分物质的量与上述平衡相同。若维持反应向正方向进行,则起始时c的取值范围是。
(5分)(1)请指出乙烯的一种用途:。
(2)将乙烯通入到溴的四氯化碳溶液中,其化学方程式为:反应的类型是;
(3)甲烷与氯气反应生成气态有机物的反应方程式反应的类型是。
根据下图回答以下问题: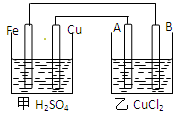
(A、B均为碳棒,两池中溶液均足量)
(1)甲装置是池,乙装置是池且Fe极为极,A极为极
(2)A极的电极反应
(3)若甲池中Fe溶解0.3 mol,则乙池中产生气体的总体积(标准状况)为L,
乙池极质量会增加g