某温度(t ℃)时,水的离子积为KW=1×10-13,则该温度__________25 ℃(选填“>”“<”“=”),其理由是____________________________________。若将此温度下pH=11的苛性钠溶液a L与pH=1的稀硫酸b L混合(设混合后溶液体积的微小变化忽略不计),试通过计算填写以下不同情况时两溶液的体积比。
(1)若所得混合溶液为中性,则a∶b=__________;此溶液中各种离子的浓度由大到小的排列顺序是__________。
(2)若所得混合液的pH=2,则a∶b=__________;此溶液中各种离子的浓度由大到小的排列顺序是__________。
A、B、C、D、E都是元素周期表中前20号元素,原子序数依次增大,A是地壳中含量最高的元素,B、C、D同周期,E和其他元素既不在同周期也不在同主族,D的氢化物和最高价氧化物的水化物均为强酸,且B、C、D的最高价氧化物的水化物两两混合均能发生反应生成盐和水。据此回答下列问题:
(1)A和D的氢化物中,沸点较高的是 __________(写出化学式)。
(2)写出A单质的结构式___________。B的最高价氧化物的水化物的电子式__________。
(3)写出E离子的离子结构示意图___________________。元素D在元素周期表中的位置是____________________。
(4)A、D、E可以形成多种盐,其中一种盐中A、D、E三种元素的原子个数比为2:2:1,该盐的名称为 __________。它的水溶液与D的氢化物的水溶液反应可生成D的单质,该离子方程式为______________________。
(1)(6分)已知实验室制备氯气的反应:MnO2 +4HCl(浓)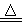 MnCl2 + Cl2↑+ 2H2O其中氧化剂是,还原剂是,氧化产物是,还原产物是,氧化剂和还原剂之比是。
MnCl2 + Cl2↑+ 2H2O其中氧化剂是,还原剂是,氧化产物是,还原产物是,氧化剂和还原剂之比是。
(2)配平氧化还原反应方程式:
__ C2O42-+__MnO4-+__H+=__CO2+__Mn2++__H2O
(3)某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)2、H2O、H2O2已知该反应中H2O2只发生如下过程:H2O2→ O2
①该反应中的氧化剂是。
②该反应中,发生还原反应的过程是→。
③写出该反应的化学方程式,并标出电子转移的方向和数目。
④如反应转移了0.6mol电子,则产生的气体在标准状况下体积为。
(6分)现有以下物质①KNO3溶液②干冰(固态的二氧化碳)③冰醋酸(纯净的醋酸)④铜⑤AgCl固体⑥蔗糖⑦酒精⑧熔融的NaCl⑨氨水⑩盐酸,其中能够导电的是_________________(填序号,下同);属于电解质的是__________________;属于非电解质的是___________________________。
回答下列问题:
(1)下列仪器中:①试管②烧杯③烧瓶④坩埚⑤蒸发皿⑥锥形瓶⑦燃烧匙。可用于直接加热的仪器是________________,需要垫石棉网加热的仪器是____________。(用序号填写)
(2)实验室中需要配制490 mL 0.10 mol·L-1的NaOH溶液。根据题意填空:
A.配制该溶液应选用玻璃仪器有:_________。
B.用托盘天平称取 ________ g NaOH固体。
(3)下列操作导致配制的溶液浓度偏低的是。
A.定容时俯视刻度线
B.将烧杯中溶解后的溶液立刻注入容量瓶,然后再添加蒸馏水至刻度线
C.摇匀定容后,用胶头滴管向容量瓶中滴加蒸馏水至刻度线
D.配制溶液前用蒸馏水润洗容量瓶
E.定容时超出刻度线,用胶头滴管将溶液吸出到刻度线。
F.移液过程中不小心将溶液溅出
利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实。某化学兴趣小组在实验室中模拟上述过程,其设计的模拟装置如下:
根据设计要求回答:
(1)B装置有三种功能:①干燥气体;②________;③________。
(2)设V(Cl2)/V(CH4)=x,若测得通入1molCH4得到四种有机产物物质的量相等,则理论上x值应为________。
(3)D装置的石棉中均匀混有KI粉末,其作用是_____________________________________。
(4)E装置的作用是___________________(填编号)。
| A.收集气体 | B.吸收氯气 | C.防止倒吸 | D.吸收氯化氢 |
(5)在C装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色小颗粒产生,写出置换出黑色小颗粒的化学方程式________________________________。
(6)E装置除生成盐酸外,还含有有机物,从E中分离出有机物的最佳方法为________。该装置还有缺陷,原因是没有进行尾气处理,其尾气主要成分为________(填编号)。
a.CH4
b.CH3Cl
c.CH2Cl2
d.CHCl3
e.CCl4