铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式 。
| |
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正、负极,并写出电极反应式。
正极反应 负极反应 。
(3)腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为
0.10mol·L-1,请参照下表给出的数据和药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤 。
| |
氢氧化物开始沉淀时的pH |
氢氧化物沉淀完全时的pH |
| Fe3+ Fe2+ Cu2+ |
1.9 7.0 4.7 |
3.2 9.0 6.7 |
| 提供的药品:Cl2 浓H2SO4 NaOH溶液 CuO Cu |
(4)某科研人员发现劣质不锈钢在酸中腐蚀缓慢,但在某些盐溶液中腐蚀现象明显。请从上表提供的药品中选择两种(水可任选),设计最佳实验,验证劣质不锈钢易被腐蚀。
有关反应的化学方程式
劣质不锈钢腐蚀的实验现象
如图杠杆AB两端分别挂着体积相同质量相同的空心铁球和空心铜球。调节杠杆使其保持平衡,一段时间后小心加入浓CuSO4溶液,回答下列有关问题(不考虑铁丝反应和两球的浮力变化)
(1)若杠杆为绝缘体,则A端_____(填“高”或“低”),发生反应的离子方程式___________。
(2)若杠杆为导体,则A端______(同上),在此过程中铁丝、杠杆、小球、CuSO4溶液构成了原电池,电极反应分别是,
正极:________________________,
负极:___________________________________。
(3)若杠杆为导体,一段时间通过杠杆电子数为0.1NA,则俩球质量相差g。
某学生为了探究锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
| 时间(min) |
1 |
2 |
3 |
4 |
5 |
| 氢气体积(mL) |
50 |
120 |
232 |
290 |
310 |
(1)哪一时间段(指0~1、1~2、2~3、3~4、4~5 min)反应速率最大 ,原因是。
(2)哪一段时段的反应速率最小,原因是 。
(3)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液:
A.Na2CO3溶液 B.NaCl溶液 C.NaNO3溶液 D.CuSO4溶液
你认为可行的是。
A、B、C、D、E、F六种短周期元素,原子序数依次增大。A、E同主族,且E元素原子的核外电子数是A元素原子核内质子数的两倍。B、C两元素原子的最外层电子数之和等于D元素原子的最外层电子数,C、D两元素原子最外层电子数之和等于F元素原子的最外层电子数。D元素原子最外层电子数是次外层电子数的一半。回答下列问题:
(1)写出E、F形成化合物所含化学键的类型;A元素在周期表中的位置是
(2)D、E、F的最高价氧化物的水化物酸性强弱顺序(用化学式表示)
(3)写出C、E对应的最高价氧化物的水化物相互反应的化学方程式为:
(4)C、D的氧化物与分别与B的氢氧化物反应的离子方程式:、
(1)按系统命名法命名:
①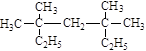 ;
;
②(CH3)2CHCH=CHCH3___________________________;
(2)写出下列各有机物的结构简式:
①2,3-二甲基-4-乙基已烷 :_______________________________;
②支链只有一个乙基且相对分子质量最小的烷烃:___________________;
(3)写出下列反应的化学方程式。
①实验室制乙烯。
②乙醇催化氧化 。
③2-氯丙烷消去反应 。
④乙醛与新制氢氧化铜 。
选考[化学一物质结构与性质]铜是应用较为广泛的有色金属。
(1)基态铜原子的核外电子排布式为。
(2)金属化合物Cu2Zn合金具有较高的熔点、较大的强度、硬度和耐磨度。Cu2Zn合金的晶体类型是。
(3)某含铜化合物的离子结构如图所示。
①该离子中存在的作用力有;
a.离子键
b.共价键
c.配位键
d.氢键
e.范德华力
②该离子中第二周期的非金属元素的第一电离能由大到小的顺序是;
③该离子中N原子的杂化类型有。
(4)铜与氧形成化合物的晶体结构如图。该化合物的化学式为,O的配位数是。