如图杠杆AB两端分别挂着体积相同质量相同的空心铁球和空心铜球。调节杠杆使其保持平衡,一段时间后小心加入浓CuSO4溶液,回答下列有关问题(不考虑铁丝反应和两球的浮力变化)
(1)若杠杆为绝缘体,则A端_____(填“高”或“低”),发生反应的离子方程式___________。
(2)若杠杆为导体,则A端______(同上),在此过程中铁丝、杠杆、小球、CuSO4溶液构成了原电池,电极反应分别是,
正极:_____________ ___________,
负极:___________________________________。
(3)若杠杆为导体,一段时间通过杠杆电子数为0.1NA,则俩球质量相差 g。
2SO2(g)+O2(g) 2SO3(g)反应过程的能量变化如图所示。
2SO3(g)反应过程的能量变化如图所示。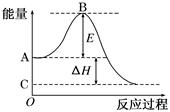
已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ/mol。请回答下列问题:
⑴图中A点表示:_____;C点表示:(填“反应物的总能量”“生成物的总能量”)
⑵E的大小对该反应的反应热________(填“有”或“无”)影响。
⑶图中ΔH=________kJ/mol。
已知化合物A、D、E、G焰色反应时,火焰均呈黄色,其中A可用作家庭食品添加剂,也可用以治疗胃酸过多。A~H各物质的变化关系如下图所示。
写出各步反应的化学方程式
反应①
反应②
反应③
反应④
反应⑤
按要求完成下列除杂问题
(1)FeCl2溶液中混有少量FeCl3,除杂试剂为,
离子方程式;
(2)FeCl3溶液中混有少量FeCl2,除杂试剂为,
离子方程式;
(3)Fe2O3中混有Al2O3,除杂试剂为,
离子方程式。
(10分)已知A为常见的金属单质,根据下图所示的关系: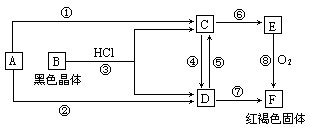
(1)确定A、B的化学式,A为 __________,B为 ___________。
(2)C和D可相互转化,描述C→D溶液的颜色变化:____________________。
④的离子方程式:_____________________________________________________。
⑤的离子方程式:_____________________________________________________。
(3)由E→F的实验现象为:___________________________________。
(6分)实验室常用浓盐酸与二氧化锰反应来制取少量的氯气,反应的化学方程式为:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。
(1)写出该反应的离子方程式___________________________________________。
(2)在反应中MnO2发生________(填“氧化”或“还原”)反应,Cl2是________(同上)产物。
(3)当0.1 mol MnO2参加反应时,转移电子数为________,被氧化的HCl为________ mol。