一种含铝、锂、钴的新型电子材料,生产中产生的废料数量可观,废料中的铝以金属铝箔的形式存在;钴以Co2O3·CoO的形式存在,吸附在铝箔的单面或双面;锂混杂于其中。
从废料中回收氧化钴(CoO)的工艺流程如下:
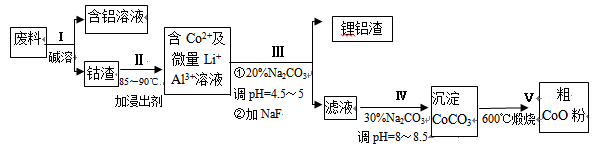
(1)过程I中采用NaOH溶液溶出废料中的Al,反应的离子方程式为 。
(2)过程II中加入稀H2SO4酸化后,再加入Na2S2O3溶液浸出钴。则浸出钴的化学反应方程式为(产物中只有一种酸根) 。在实验室模拟工业生产时,也可用盐酸浸出钴,但实际工业生产中不用盐酸,请从反应原理分析不用盐酸浸出钴的主要原因_______________。
(3)过程Ⅲ得到锂铝渣的主要成分是LiF和Al(OH)3,碳酸钠溶液在产生Al(OH)3时起重要作用,请写出该反应的离子方程式________________________。
(4)碳酸钠溶液在过程III和IV中所起作用有所不同,请写出在过程IV中起的作用是
____________________________________________________________。
(5)在Na2CO3溶液中存在多种粒子,下列各粒子浓度关系正确的是______(填序号)。
| A.c(Na+) = 2c(CO32-) | B.c(Na+) > c(CO32-) > c(HCO3-) |
| C.c(OH-) > c(HCO3-) > c(H+) | D.c(OH-) - c(H+)=c(HCO3-) + 2c(H2CO3) |
A.《化学与生活》
(1)材料是经济和生态文明建设的重要物资基础
①生产硅酸盐水泥和普通玻璃都需用到的共同原料是________。
②橡胶是制造轮胎的重要原料,橡胶属于_______ (填字母)
A.金属材料 B.无机非金属材料 C.有机高分子材料
③钢铁制品在潮湿的空气中能发生_______腐蚀,发生该腐蚀时的负极电极反应式为________。
(2)防冶环境污染,改善生态环境已成为全球共识
①2013年,全国多个省市出现严重的雾天气,导致雾形成的主要污染物是_____(填字母)
A.O2 B.CO2 C.PM2.5
②采用焚烧处理垃圾进行发电已在江苏投入使用。下列是生活中的常见垃圾;
A.废电池 B.易拉罐 C.玻璃瓶
在焚烧前,除废电池外,还有_______(填字母)应剔除并回收,随意丢弃电池造成的主要危害是_______。
③漂白粉可用于生活用水的杀菌消毒,工业上利用氯气和石灰乳制取漂白粉的化学方程式是_______。
(3)合理膳食,保持营养均衡,是青少年学生健康成长的重要保证。
①维生素C能增强人体对疾病的抵抗能力,促进人体生长发育,中学生每天要补充60mg的维生素C;下列物质含有丰富维生素C的是______(填字母)
A.牛肉 B.辣椒 C.鸡蛋
②青少年及成人缺乏某种微量元素将导致甲状腺肿大,而且会造成智力损害,该微量元素是______(填字母)A.碘 B.铁 C.钙
③蛋白质是人体必需的营养物质,它在人体内最终水解为___________。
(4)材料是人类生存和发展的物质基础,合理使用材料可以改善我们的生活。
①居室装修所使的人造板材会释放出一种挥发性物质,长期接触会引起过敏性皮炎,免疫功能异常,该挥发性物质是_________。
②玻璃是重要的硅酸盐产品,生产玻璃时,石灰石与石英反应的化学方程式为___________。
在热的稀硫酸中溶解了11.4 g FeSO4固体,当加入50 mL 0.5 mol·L-1 KNO3溶液时,其中的Fe2+全部转化成Fe3+,KNO3也完全反应并放出NxOy气体。
(1)推算出x=________;y=________。
(2)配平该反应的方程式:
____FeSO4+___KNO3+____H2SO4 = ____K2SO4+____Fe2(SO4)3+____ (NxOy)+____H2O(配平时x、y用具体数值表示,物质填在
(NxOy)+____H2O(配平时x、y用具体数值表示,物质填在 中)。
中)。
(3)反应中氧化产物是__________。
(1)赤铜矿的主要成分是Cu2O,辉铜矿的主要成分是Cu2S。赤铜矿与辉铜矿混合加热发生以下反应:Cu2S+2Cu2O===6Cu+SO2。氧化剂是________,还原剂是________每生成19.2 g Cu,反应中转移电子数_________
(2)已知8NH3+3Cl2 = 6NH4Cl+N2,氧化剂与还原剂的分子个数比为________;当有4mol NH3被氧化时,生成的还原产物为________ g。
(1)在标准状况下,CO和CO2混合气体的密度是相同条件下H2密度的16倍,则该混合气体的平均相对分子质量为______________ ;若在该条件下混合气体的物质的量为1mol,则其中CO所占的体积为______________ ,CO2所占的质量为__________________。
(2)NaHSO4在水中的电离方程式: ___________;
若将NaHSO4与Ba(OH)2在溶液中按物质的量2:1混合,反应的离子方程式是______________
有下列物质:① 氢氧化铜固体;② 铜丝;③ 氯化氢气体;④ 稀硫酸;⑤ 二氧化碳气体;⑥ 氨水;⑦ 碳酸钙固体;⑧ 蔗糖晶体;⑨ 熔融氯化钠;⑩醋酸;请用序号填空:
(1)上述状态下可导电的是_________________________;
(2)属于弱解质的是_____________________________;
(3)属于非电解质的是_____________________________;