某配位化合物为深蓝色晶体,由原子序数由小到大的A、B、C、D、E五种元素构成,其原子个数比为14:4:5:1:1。其中C、D元素同主族且原子序数D为C的二倍,E元素的外围电子排布为(n-l)dn+6nsl,回答下列问题。
(1)该配位化合物的化学式为 。元素B、C、D的第一电离能由大到小的排列顺序为_______(用元素符号表示)。
(2)D元素原子的最外层电子排布图为 ,DC42-的立体构型为 。
(3)A元素与E元素可形成一种红色化合物,其晶体结构单元如图。
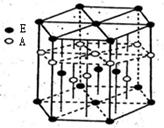
则该化合物的化学式为 ,该化合物可在氯气中燃烧,生成一种棕黄色固体和一种气体,写出该反应的化学方程式 。
(12分)下图类似奥运五元环,表示A、B、C、D、E五种化合物,元环交叉部分代表两种化合物含有一种相同元素,五种化合物由五种短周期元素组成,且每种化合物仅由两种元素组成.A是可燃冰的主要成分;B、E分子中所含电子总数均与硅烷(SiH4)分子的电子数相等,B不稳定,具有较强氧化性,能发生自身氧化还原反应,E的相对分子质量为32,具有还原性,且常用作航天器的燃料; C能发生反应:化合物(Ⅰ)+化合物(Ⅱ)  化合物(Ⅲ)+化合物(Ⅳ);D是新型无机非金属材料,它所含两种元素的原子个数之比为3∶4,电子数之比为3∶2.
化合物(Ⅲ)+化合物(Ⅳ);D是新型无机非金属材料,它所含两种元素的原子个数之比为3∶4,电子数之比为3∶2.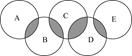
(1) D的化学式为________.
(2)A、B、E中含有一种相同的元素,其在周期表中的位置________.
(3)B和E反应可生成单质G和常见的液态化合物H,写出化学方程式__________________.
(4)写出C符合“化合物(Ⅰ)+化合物(Ⅱ)  化合物(Ⅲ)+化合物(Ⅳ)”的化学方程式________________________________.
化合物(Ⅲ)+化合物(Ⅳ)”的化学方程式________________________________.
(12分)已知:①A、B、C、D四种物质均含有元素X,可能还含有元素Y或Z。元素Y、X、Z的原子序数依次递增且不超过20。② X在A、B、C、D中的化合价分别为0、-1、+1、+5。③室温下单质A与某种常见一元强碱溶液反应,可得到B和C。④化合物D在二氧化锰催化下受热分解,可制得元素Y的单质。请回答下列问题:
(1)写出B、C、D的化学式:B __,C,D。
(2)用电子式表示C的形成过程。
(10分)按下列要求回答:现有①BaCl2;②金刚石;③NH4Cl;④Na2SO4;⑤干冰;⑥碘
(1)熔化时不需要破坏化学键的是__________(填序号,下同),熔点最低的是__________。
(2)属于离子化合物的是__________
(3)①的电子式是________________,⑤的电子式是________________。
若X、 Y两种元素在周期表中位于同一主族,且相隔一个周期,并有m=n>0。在一定条件下有下列反应(未配平):Xm + Yn + H2O→ HXO3 + HY
请回答:(1)该反应的还原剂的电子式为___________________。
(2)配平上述化学方程式(用化学式表示):
(3)若某化学反应如下:(未配平)
KX+ Yn + H2O→ KXO3 + Xm+ HY + KY
若KXO3和Xm的化学计量数均为1,则Yn的化学计量数为____________。
在下面化学式上标出电子转移的方向和数目
KX+ Yn + H2O→
(4)已知:在反应中,若氧化反应和还原反应发生在同一分子内部处于同一化合价的同种元素上,使该元素的原子(或离子)一部分被氧化,另一部分被还原。这种自身的氧化还原反应称为歧化反应。实验室模拟KXO3的制法如下: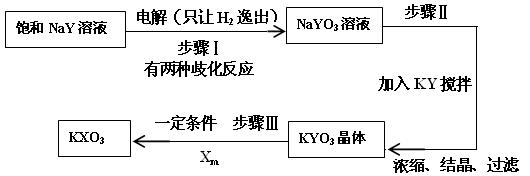
①在进行步骤Ⅰ实验时,有学生主张电解装置用U形管,有的学生主张用烧杯,你认为用哪种仪器更合适______________(填名称)。
②步骤Ⅰ的阴极电极反应式为(用化学式表示):_____________________。
③步骤Ⅰ中生成NaYO3的歧化反应的离子方程式为(用化学式表示): ____________。
④步骤Ⅱ中向NaYO3的溶液中加入粉末状的KY,搅拌后生成KYO3。已知有2L 3mol/L的NaYO3溶液,则至少需要加入__________mol KY粉末可将溶液中的YO3-离子沉淀至浓度变为0.1mol/L。(已知Ksp(KYO3)= 0.366,计算结果保留两位小数,加入KY粉末后溶液体积不变 )、
现有一种有机物A,分子式为C4H6O6。对于A的结构与性质实验结论如下:
i:A的分子中有两个羧基;
ii:A的核磁共振氢谱如下图所示;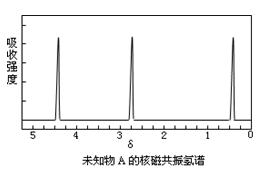
下图是利用烃B和烃I合成有机物A和一种高分子新材料R的转化关系示意图,已知烃I的相对分子质量为28,且F的相对分子质量比E多28。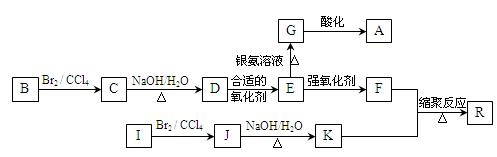
已知: 
②同一个碳原子上连有多个羟基的结构极不稳定,不予考虑。
请分析并按要求回答下列问题:
(1)写出A对应的结构简式:;
(2)写出对应反应的化学方程式:
C→D:;反应类型为:______________________;
E→G:;
F+K→R:;
(3)有机物E的同分异构体M满足下列三个条件:
①1 mol有机物与银氨溶液充分反应生成2 mol Ag
②1 mol有机物与足量NaHCO3溶液反应产生1 mol CO2
③1 mol有机物与足量金属Na反应产生1 mol H2
请判断M的结构可能有种,任写一种M的结构简式。