下表是A、B、X、Y、Z五种有机物的有关信息:
| A |
 B B |
X |
Y |
Z |
|||
| ①能使溴的四氯化碳溶液褪色; ②比例模型为:
|
①由C、H两种元素组成; ②球棍模型为:  |
①由C、H、O三种元素组成; ②能与Na反应,但不能与NaOH溶液反应; ③能与Z反应生成相对分子质量为100的酯。 |
①相对分子质量比X少2; ②能由X氧化而成; |
①由C、H、O三种元素组成; ②球棍模型为:  |
根据表中信息回答下列问题:
(1)A与溴的四氯化碳溶液反应的生成物的名称叫做 ,写出在一定条件下,A生成高分子化合物的化学反应方程式__ _____。
(2) A与氢气发生加成反应后生成分子F,F在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通式CnH2n+2。当n=__________时,这类有机物开始出现同分异构体。
(3) B具有下列性质中的哪些? (填号):
①无色无味液体 ②有毒 ③不溶于水 ④密度比水大
⑤与酸性KMnO4溶液和溴水反应褪色 ⑥任何条件下不与氢气反应
写出在浓硫酸作用下,B与浓硝酸反应的化学方程式: 。
(4)X与Z反应能生成相对分子质量为100的酯,该反应类型为 ;其化学反应方程式为: 。
(5) 写出由X氧化生成Y的化学反应方程式: 。
A是一种含碳、氢、氧三种元素的有机化合物。已知:A中碳的质量分数为44.1%,氢的质量分数为8.82%;A只含一种官能团,且每个碳原子上最多只连一个官能团;A能与乙酸发生酯化反应,但不能在两个相邻碳原子上发生消去反应。请填空:
(1)A的分子式是__________________,其结构简式是__________________。
(2)写出所有满足下列3个条件的A的同分异构体的结构简式:①属直链化合物;②与A具有相同的官能团;③每个碳原子上最多只连一个官能团。这些同分异构体的结构简式是________________________________________________________________________。
某有机化合物A的相对分子质量大于110,小于150。经分析得知,其中碳和氢的质量分数之和为52.24%,其余为氧。请回答:
(1)该化合物分子中含有几个氧原子,为什么?
(2)该化合物的相对分子质量是___________________。
(3)该化合物的化学式(分子式)是__________________。
(4)该化合物分子中最多含_________个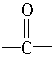 官能团。
官能团。
通常,烷烃可以由相应的烯烃经催化加氢得到。有一种烷烃A,分子式是C9H20,它却不能由任何C9H18的烯烃催化加氢得到;而另有A的三个同分异构体B、C、D,却分别可由而且只能由1种相应的烯烃催化加氢得到。A及另外三种同分异构体的结构简式分别是:_______________、_________________、________________、_______________。
吗啡和海洛因都是严格查禁的毒品,吗啡分子中C、H、N的质量分数依次为715.8%、6.67%、4.91%,其余为氧。
(1)写出吗啡的化学式:________________________,并计算其相对分子质量(已知吗啡的相对分子质量不超过300):_________。
(2)已知海洛因是吗啡的二乙酸酯,则海洛因的相对分子质量为_________,化学式为__________________。
取3.40 g只含羟基,不含其他官能团的液态饱和多元醇,置于5.00 L氧气中,经点燃,醇完全燃烧。反应后气体体积减少0.56 L。将气体经足量NaOH溶液吸收,体积又减少2.80 L(所有体积均在标准状况下测定)。
(1)3.40 g醇中C、H、O物质的量分别为C_________mol,H_________mol,O_________mol,该醇中C、H、O的原子数之比为_________。
(2)由以上比值能否确定该醇的化学式?_________,其原因是______________________。
(3)如果将该多元醇的任意一个羟基换成一个卤原子,所得到的卤代物都只有一种,试写出该饱和多元醇的结构简式:__________________。