硼镁泥是一种工业废料,主要成份是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质。以硼镁泥为原料制取的硫酸镁,可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO4·7H2O的流程如下:

根据题意回答下列问题:
(1)在酸解过程中,想加快酸解速率,请提出两种可行的措施__________、______________。
(2)滤渣的主要成份除含有Fe(OH)3、Al(OH)3、MnO2外,还有 。
(3)加入的NaClO可与Mn2+反应产生MnO2沉淀,该反应的离子方程式是 。在调节pH、发生水解之前,还有一种离子也会被NaClO氧化,该反应的离子方程式为 。
(4)如何检验滤液中Fe3+是否被除尽,简述检验操作 。
(5)已知MgSO4、CaSO4的溶解度如下表:
| 温度(℃) |
40 |
50 |
60 |
70 |
| MgSO4 |
30.9 |
33.4 |
35.6 |
36.9 |
| CaSO4 |
0.210 |
0.207 |
0.201 |
0.193 |
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明除钙的操作步骤 、 。
(6)现有l.60 t硼镁泥,生产MgSO4·7H2O,若生产过程的产率为50%,则能生产出MgSO4·7H2O产品 t (计算结果保留三位有效数字)。(H:1 O:16 Mg:24 S:32)
(12分)
碳、硫的含量影响钢铁性能。碳、硫含量的一种测定方法是将钢样中的碳、硫转化为气体,再用测碳、测硫装置进行测定。
(1)采用装置A,在高温下将x g钢样中的碳、硫转化为CO2、SO2。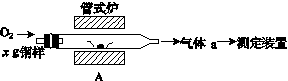
①气体a的成分是______。
②若钢样中硫以FeS形式存在,A中反应:3FeS+5O2 1________+3________。
1________+3________。
(2)将气体a通入测硫装置中(如图),采用滴定法测定硫的含量。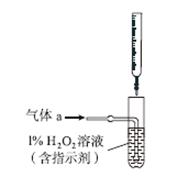
①H2O2氧化SO2的化学方程式:__________________。
②用NaOH溶液滴定生成的H2SO4,消耗z mL NaOH溶液。若消耗1 mL NaOH溶液相当于硫的质量为y g,则该钢样中硫的质量分数:________。
(3)将气体a通入测碳装置中(如图),采用重量法测定碳的含量。
①气体a通过B和C的目的是________________________________________。
②计算钢样中碳的质量分数,应测量的数据是_________________________。
(12分)已知A、B、C、D、E、F、G都是短周期的元素,它们的原子序数依次递增.A原子的电子层数与它的核外电子总数相同,而B原子的最外层电子数是次外层的2倍,C的氢化物可使湿润的红色石蕊试纸变蓝,B和D可以形成两种气态化合物,E原子核外电子总数比B的2倍少1,D与F同主族,G的原子半径是本周期元素中最小的.则:
(1)运送飞船的火箭燃料有一种液态化合物是由A、C元素组成的,已知该化合物的相对分子质量为32,其中氢元素的质量分数为12.5%.若该化合物与A2D2恰好完全反应,能产生两种无毒又不污染环境的物质,试写出该反应的化学方程式:__________________。
(2)C的原子间也可形成链状结构,假设C原子间只以单键形式连接,并与A形成系列化合物,则该系列化合物的通式为___________________________。
(3)由B和D以质量比为3∶8组成的化合物与E的同周期相邻主族元素的单质反应的化学方程式为________________________________________。
(4)F单质与E的最高价氧化物的水化物反应的离子方程式为_____________________。
N元素有多种化合物,它们之间可以发生转化,如:N2H4+HNO2=2H2O+HN3。请回答下列问题:
(1)N与O电负性较大的是。
(2)NaN3的晶体类型是。
(3)纯叠氮酸HN3在常温下是一种液体,沸点较高,为308.8K,主要原因是。
(4)N2H4中的N原子的杂化类型是。
(5)NO2-离子是一种很好的配位体,能提供孤电子对是。
A.氧原子 B.氮原子 C.两者都可以
NO2-与钴盐通过配位键形成的[Co(NO2)6]3-能与K+离子结合生成黄色K3[Co(NO2)6]沉淀,此方法可用于检验溶液中的K+离子,写出该配合物中钴离子的电子排布式。
(16分)亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图: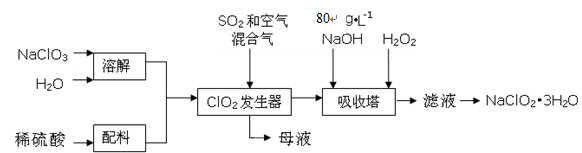
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2•3H2O。
②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全。
③80 g·L-1 NaOH溶液是指80 g NaOH固体溶于水所得溶液的体积为1L。
(1)80 g·L-1 NaOH溶液的物质的量浓度为;
(2)发生器中鼓入空气的作用可能是(选填序号);
a.将SO2氧化成SO3,增强酸性 b.将NaClO3氧化成ClO2 c.稀释ClO2以防止爆炸
(3)从“母液”中可回收的主要物质是;
(4)吸收塔内的反应的化学方程式为;
吸收塔的温度不能超过20℃,其目的是;
(5)在碱性溶液中NaClO2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是否过量的简单实验方法是;
(6)吸收塔中为防止NaClO2被还原成NaCl,所用还原剂的还原性应适中。除H2O2外,还可以选择的还原剂是(选填序号);
a.Na2S b.Na2O2 c.FeCl2
(7) 从吸收塔出来的溶液中得到NaClO2•3H2O粗晶体的实验操作依次是(选填序号)。
a.蒸发浓缩 b.蒸馏 c.过滤 d.灼烧 e.冷却结晶
(13分)已知工业盐中含有NaNO2,外观和食盐相似,有咸味,人若误食会引起中毒,致死量为0.3~0.5g。已知NaNO2能发生如下反应(方程式已配平):2NO2-+xI-+yH+=2NO↑+I2+zH2O,请回答下列问题:
(1)上述反应中,x =________, y =________,z =________,氧化剂是________________。
(2)根据上述反应,鉴别NaNO2和NaCl可选用的物质有:①碘化钾淀粉试纸、②淀粉、③食醋、④白酒,你认为必须选用的物质有________________(填序号)。
(3)某工厂废切削液中含有2%~5%的NaNO2,直接排放会造成水污染,但加入下列物质中的某一种就能使NaNO2转化为不引起污染的N2,该物质是________________。
| A.NaCl | B.KMnO4 | C.浓硫酸 | D.NH4Cl |
(4)饮用水中的NO3-对人类健康会产生危害,为了降低饮用水中NO3-的浓度,某饮用水研究人员提出,在碱性条件下用铝粉将NO3-还原为N2,请配平化学方程式:
10Al+6NaNO3 + 4NaOH + 18H2O=□ ________ + 3N2↑。若反应过程中转移0.5mol电子,则生成标况下的N2体积为________。