(12分)
碳、硫的含量影响钢铁性能。碳、硫含量的一种测定方法是将钢样中的碳、硫转化为气体,再用测碳、测硫装置进行测定。
(1)采用装置A,在高温下将x g钢样中的碳、硫转化为CO2、SO2。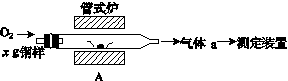
①气体a的成分是______。
②若钢样中硫以FeS形式存在,A中反应:3FeS+5O2 1________+3________。
1________+3________。
(2)将气体a通入测硫装置中(如图),采用滴定法测定硫的含量。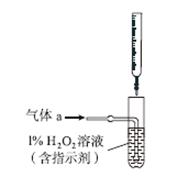
①H2O2氧化SO2的化学方程式:__________________。
②用NaOH溶液滴定生成的H2SO4,消耗z mL NaOH溶液。若消耗1 mL NaOH溶液相当于硫的质量为y g,则该钢样中硫的质量分数:________。
(3)将气体a通入测碳装置中(如图),采用重量法测定碳的含量。
①气体a通过B和C的目的是________________________________________。
②计算钢样中碳的质量分数,应测量的数据是_________________________。
(1)由A、B两元素组成的离子晶体结构(甲)如图所示,则该晶体的化学式是:。
(2)C原子的最外层电子排布为nsnnpm,其某一激发态可使这两个亚层的每一个轨道都处于充满状态,1个C原子与2个D原子结合,使双方都达 到8电子稳定结构。则在C与D形成的分子中,C原子发生轨道的杂化方式是
到8电子稳定结构。则在C与D形成的分子中,C原子发生轨道的杂化方式是 ,分子构型是,从成键方式
,分子构型是,从成键方式 看,该分子中含有的共价键的类型和数目分别是。
看,该分子中含有的共价键的类型和数目分别是。
(3)C与D形成的常见晶体(乙),与甲晶体的熔点相比,乙甲,其原因是。
A、B、C、D是四种短周期元素,E是过渡元素。A、B、C同周期,C、D同主族,A的原子结构示意图为:,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。回答下列问题:
(1)写出下列元素的符号:A _______ B______ C ________ D _________
(2)用化学式表示上述五种元素中最高价氧化物对应水化物酸性最强的是__________,碱性最强的是_________。
(3)用元素符号表示D所在周期(除稀有气体元素外)第一电离能最大的元素是__________,电负性最大的元素是__________。
(4)D的氢化物比C的氢化物的沸点__________(填"高"或"低"),原因__________
(5)E元素在周期表的第___周期,第_____族, E3+原子结构示意图为
(6)A、B、C最高价氧化物的晶体类型是分别是_____晶体、____晶体、___晶体
(7)画出D的核外电子排布图___________________________________ ________,这样排布遵循了____________原理和____________规则。
________,这样排布遵循了____________原理和____________规则。
(8)用电子式表示B的硫化物的形成过程:______________________________________
已知有关物质的熔、沸点数据如下表:

请参考上述数据回答下列问题:
(1)工业上常用电解熔融MgCl2的方法生产金属镁,电解Al2O3与冰晶石熔融混合物的方法生产铝。为什么不用电解MgO的方法生产镁;也不用电解AlCl3的方法生产铝?
答___________。 (2)设计可靠的实验证明MgCl2、AlCl3所属的晶体类型,其实验方法是_______。
(2)设计可靠的实验证明MgCl2、AlCl3所属的晶体类型,其实验方法是_______。
(每空2分,共8分)有A、B、C、D四种溶液,它们各为K2CO3、K2SO4、NaHSO4、Ba(NO3)2中的一种。现进行下列实验:A+C无明显变化;A+D无明显变化;B+D生成溶液及沉淀物E;B+C生成溶液F及沉淀;少量E溶于过量F中,生成 溶液并放出气体。
溶液并放出气体。
(1).写出NaHSO4的电离方程式_________________________________;
(2).写出下列物质的化学式:
A是__________ B是__________ D是_________
(每空2分,共8分)按要求写出下列反应的离子方程式或化学方程式:
⑴写出离子反应方程式CO2+2OH-=CO32-+H2O所对应的两个化学方程式
①
②
⑵书写下列反应的离子方程式:
①氧化铜与稀盐酸反应 :
②CO2通入到足量的澄清石灰水: