利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制硝酸,在工业上一般可进行连续生产。请回答下列问题:
(1)已知:N2(g)+O2(g)=2NO(g);△H= +180.5kJ/mol N2(g)+3H2(g)
N2(g)+3H2(g)  2NH3(g);△H= -92.4kJ/mol
2NH3(g);△H= -92.4kJ/mol
2H2(g)+O2(g)=2H2O(g) ;△H= -483.6kJ/mol
氨气经催化氧化生成一氧化氮气体和水蒸气反应的热化学方程式为 。
(2)在容积固定的密闭容器中发生上述氨气的催化氧化反应,容器内部分物质的物质的量浓度如下表:
| 时间/浓度 |
c(NH3)(mol/L) |
C(O2)(mol/L) |
C(NO)(mol/L) |
| 起始 |
0.8 |
1.6 |
0 |
| 第2min |
0.6 |
a |
0.2 |
| 第4min |
0.3 |
0.975 |
0.5 |
| 第6min |
0.3 |
0.975 |
0.5 |
| 第8min |
0.54 |
0.9 |
0.56 |
①起始时物料比c (O2):c (NH3)>1.25,其原因是 。
②反应在第2min到第4min时O2的平均反应速率为 ;
③反应在第2min改变了反应条件,改变的条件可能是 或
④若反应在第6min后仅改变一种反应条件。所改变的条件和判断的理由是
。
有机物
可作为植物生长调节剂,为便于使用,通常将其制成化合物
 ,
在弱酸性条件下会缓慢释放出
。合成
的一种方法及各物质间转化关系如下图所示:
,
在弱酸性条件下会缓慢释放出
。合成
的一种方法及各物质间转化关系如下图所示:
请回答下列问题:
(1)
的名称是_,
与氯气反应可生成
,
的名称是;
(2)经测定
中含有氯元素,且
可以与乙酸发生酯化反应,则
的结构简式为,由
直接生成
的反应类型是;
(3)在弱酸性条件下,
与水反应生成
的化学方程式为;
(4)写出
的两个同分异构体的结构简式。
是自然界存在最广泛的
族元素,常以化合物
存在。从单质A起始发生的一系列化学反应可由下图表示: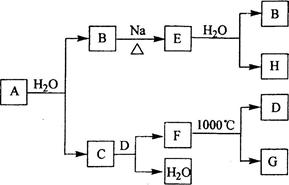
请回答下列问题:
(1)
与水反应的化学方程式为,
与水反应的化学方程式为;
(2)
的化学式为,
和
的电子式分别为;
(3)
与
反应可能生成的盐有(填化学式);
(4)实际生产中,可由
为原料制备单质
,简述一种制备方法。
高炉炼铁过程中发生的主要反应为
已知该反应在不同温度下的平衡 常数如下:
常数如下:
请回答下列问题:
(1)该反应的平衡常数表达式
=,
0(填">"、"<"或"=");
(2)在一个容积为10
的密闭容器中,1000℃时加入
、
、
、
各1.0
,反应经过l0
后达到平衡。求该时间范围内反应的平均反应速率
=、
的平衡转化率=:
(3)欲提高(2)中
的平衡转化率,可采取的措施是。
A.减少 的量
B.增加 的量
C. 移出部分
D.提高反应温度
E.减小容器的容积
F.加入合适的催化剂
(I已知: ,如果要合成
,如果要合成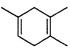 所用的原始原料可以是
所用的原始原料可以是
A. 2-甲基-l,3-丁二烯和2-丁炔 B.1,3-戊二烯和2-丁炔
C.2,3-二甲基-1,3-戊二烯和乙炔 D、2,3-二甲基-l,3-丁二烯和丙炔
II
都是有机化合物,它们的转化关系如下:
请回答下列问题:
(1)已知:6.0
化合物
完全燃烧生成8.8
和3.6
;
的蒸气与氢气的相对密度为30,则
的分子式为:
(2)
为一取代芳烃,
中含有一个甲基。由
生成
的化学方程式为;
(3)由
生成
、由
生成
的反应条件分别是、;
(4)由
生成
、由
生成
的反应类型分别是、;
(5) 存在于栀子香油中,其结构简式为;
存在于栀子香油中,其结构简式为;
(6)在
的同分异构体中,苯环上一硝化的产物只有一种的共有个,其中核磁共
振氢谱有两组峰,且峰面积比为l:1的是 (填结构简式)。
钒(
)及其化合物广泛应用于工业催化、新材料和新能源等领域.
(1)
是接触法制硫酸的催化剂.
①一定条件下,
与空气反映t
后,
和
物质的量浓度分别为
和
, 则
起始物质的量浓度为mol/L ;生成
的化学反应速率为
.
②工业制硫酸,尾气
用吸收.
(2)全钒液流储能电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如题29图所示.
①当左槽溶液逐渐由黄变蓝,其电极反应式为
②充电过程中,右槽溶液颜色逐渐由色变为色.
③放电过程中氢离子的作用是和;充电时若转移的电子数为3.01 1023个,左槽溶液中
的变化量为.
1023个,左槽溶液中
的变化量为.