是自然界存在最广泛的族元素,常以化合物存在。从单质A起始发生的一系列化学反应可由下图表示:
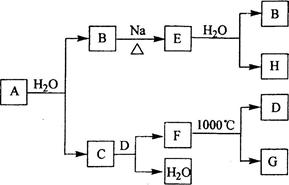
请回答下列问题:
(1)与水反应的化学方程式为,与水反应的化学方程式为;
(2)的化学式为,和的电子式分别为;
(3)与反应可能生成的盐有(填化学式);
(4)实际生产中,可由为原料制备单质,简述一种制备方法。
【选修5:有机化学基础】以下是某课题组设计的合成聚酯类高分子材料的路线:
已知:同一碳原子上连两个羟基时结构不稳定,易脱水生成醛或酮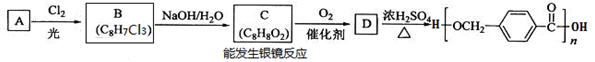
请根据以上信息回答下列问题:
(1)烃A的结构简式为 ,A的化学名称为__________。
(2)由B生成C的化学方程式为 。
(3)C的同分异构体中,既能与FeCl3溶液发生显色反应,又能发生银镜反应的有机物共有______种,其中在核磁共振氢谱中出现五组峰的有机物的结构简式为_________。
(4)D的结构简式为 ,D的某同分异构体中含有苯环的碳酸二酯在酸性条件下发生水解反应的化学方程式为 。
【选修3:物质结构与性质】某钙钛型复合氧化物(如图),以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe时,这种化合物的电阻率在有外磁场作用时较之无外磁场作用时存在巨大变化(巨磁电阻效应)。
(1)用A、B、O表示这类特殊晶体的化学式 。在图中,与A原子配位的氧原子数目为 。
(2)基态Cr原子的核外电子排布式为 ,其中电子的运动状态有 种。
(3)某些钙钛型复合氧化物能够催化NO直接分解为N2和O2,N和O的基态原子中,未成对的电子数目比为 。
(4)下表是几种碳酸盐的热分解温度和阳离子半径
| 碳酸盐 |
CaCO3 |
SrCO3 |
BaCO3 |
| 热分解温度/℃ |
900 |
1172 |
1360 |
| 阳离子半径/pm |
99 |
112 |
135 |
请解释碳酸钙热分解温度最低的原因:_____________。
(5)用晶体的X射线衍射法可以测得阿伏伽德罗常数。对金属钙的测定得到以下结果:晶胞为面心立方最密堆积,边长为a pm,阿伏加德罗常数的值为NA,金属钙的密度为 g·cm-3(用含a和NA的式子表示)。
【选修2:化学与技术】氯碱工业是最基本的化学工业之一,离子膜电解法为目前普遍使用的生产方法,其生产流程如下图所示:

(1)该流程中可以循环的物质是 。
(2)电解法制碱的主要原料是饱和食盐水,由于粗盐水中含有Ca2+、Mg2+、SO42-等无机杂质,所以在进入电解槽前需要进行两次精制,写出一次精制中发生的离子方程式 ,若食盐水不经过二次精制就直接进入离子膜电解槽会产生什么后果 。
(3)上图是工业上电解饱和食盐水的离子交换膜电解槽示意图(阳极用金属钛网制成,阴极由碳钢网制成)。则B处产生的气体是 ,E电极的名称是 。
(4)从阳极槽出来的淡盐水中,往往含有少量的溶解氯,需要加入8%~9%的亚硫酸钠溶液将其彻底除去,该反应的离子方程式为 。
(5)已知在电解槽中,每小时通过1安培的直流电可以产生1.492g的烧碱,某工厂用300个电解槽串联生产8小时,制得30%的烧碱溶液(密度为1.342吨/m3)113m3,电解槽的电流强度1.45 ×104A,该电解槽的电解效率为 。
运用化学反应原理研究氮、硫等单质及其化合物的反应有重要意义。
(1)硫酸生产过程中2SO2(g)+O2(g) 2SO3(g),平衡混合体系中SO3的百分含量和温度的关系如图所示,根据下图回答下列问题:
2SO3(g),平衡混合体系中SO3的百分含量和温度的关系如图所示,根据下图回答下列问题: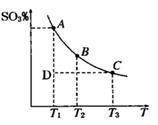
①2SO2(g)+O2(g) 2SO3(g)的△H______0(填“>”或“<”)。
2SO3(g)的△H______0(填“>”或“<”)。
②一定条件下,将SO2与O2以体积比2:1置于一体积不变的密闭容器中发生以上反应,能说明该反应已达到平衡的是___________(填字母编号)。
a.体系的密度不发生变化
b.SO2与SO3的体积比保持不变
c.体系中硫元素的质量百分含量不再变化
d.单位时间内转移4 mol 电子,同时消耗2 mol SO3
e.容器内的气体分子总数不再变化
(2)一定的条件下,合成氨反应为:N2(g)+3H2(g) 2NH3(g)。图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
2NH3(g)。图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。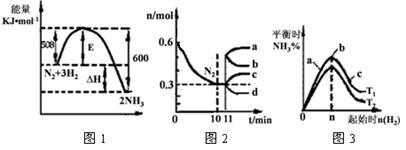
①该反应的平衡常数表达式为 ,升高温度,平衡常数 (填“增大”或“减小”或“不变”)。
②由图2信息,计算0~10min内该反应的平均速率v(H2)= ,从11min起其它条件不变,压缩容器的体积为1L,则n(N2)的变化曲线为 (填“a”或“b”或“c”或“d”)。
③图3 a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是 点,温度T1 T2(填“>”或“=”或“<”)
(3)若将等物质的量的SO2与NH3溶于水充分反应,所得溶液呈 性,所得溶液中c(H+)- c(OH-)= (填写表达式)(已知:H2SO3:Ka1=1.7×10-2,Ka2=6.0×10-8,NH3·H2O:Kb=1.8×10-5)。
(8 分)某汽车安全气囊的产气药剂主要含有NaN3、Fe2O3、KClO4、NaHCO3等物质,当汽车发生碰撞时,产气药剂产生大量气体使气囊迅速膨胀,从而起到保护作用。
(1)NaN3是气体发生剂,受热分解产生N2和Na,N2的电子式为 。
(2)Fe2O3是主氧化剂,与Na反应生成的还原产物为 (已知该反应为置换反应)。
(3)NaHCO3是冷却剂,吸收产气过程中释放的热量而发生分解,其化学方程式为 .
(4)100g上述产气药剂产生的气体通过碱石灰后得到N233.6L(标准状况)。
①用碱石灰除去的物质为 ;
②该产气药剂中NaN3的质量分数为 。