(1)高炉冶铁过程中,甲烷在催化反应室中产生水煤气(CO和H2)还原氧化铁,有关反应为:CH4(g)+CO2(g)===2CO(g)+2H2(g) ΔH=+260 kJ·mol-1
已知:2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ·mol-1
则CH4与O2反应生成CO和H2的热化学方程式为_________________;
(2)如下图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜。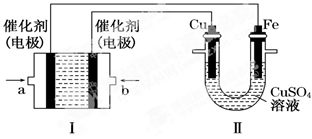
①a处应通入 (填“CH4”或“O2”),a处电极上发生的电极反应式是_______________;
②电镀结束后,装置Ⅰ中KOH溶液的浓度(忽略溶液体积的变化)_______(填写“变大”“变小”或“不变”,下同),装置Ⅱ中Cu2+的物质的量浓度________;
③电镀结束后,装置Ⅰ溶液中的阴离子除了OH-以外还含有__________;
④在此过程中若完全反应,装置Ⅱ中阴极质量变化12.8 g,则装置Ⅰ中理论上消耗甲烷________L(标准状况下)。
钛(Ti)被誉为“21世纪的金属”。工业上将TiO2与焦炭混合,通入Cl2高温下制得TiCl4;再将TiCl4提纯后,在氩气保护下与镁高温反应制得Ti。其反应如下:
①TiO2+2Cl2+2C TiCl4+2CO②TiCl4+2Mg
TiCl4+2CO②TiCl4+2Mg Ti+2MgCl2
Ti+2MgCl2
回答下列问题:
(1)已知TiCl4在通常情况下是无色液体,熔点为–37℃,沸点为136℃;TiCl4在潮湿空气中易水解产生白雾,同时产生H2TiO3固体。
① TiCl4为______晶体。② TiCl4分子为正四面体形,则Ti为________杂化。
③ TiCl4在潮湿空气中水解的化学方程式是_________________________________。
(2)配离子[TiCl(H2O)5]2+的中心离子化合价为 ,中心离子配位数为 。
实现 “节能减排” 和“低碳经济”的一项重要课题就是如何将CO2转化为可利用的资源。目前工业上有一种方法是用CO2来生产燃料甲醇。一定条件下发生反应: CO2(g)+3H2(g)
CO2(g)+3H2(g) CH3OH(g)+H2O(g),下图1表示该反应过程中能量变化:
CH3OH(g)+H2O(g),下图1表示该反应过程中能量变化: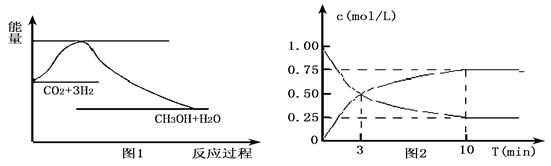
(1)关于该反应的下列说法中,正确的是____________(填字母)。
A.△H>0,△S>0 B.△H>0,△S<0
C.△H<0,△S<0 D.△H<0,△S>0
(2)为探究反应原理,现进行如下实验,在体积为l L的密闭容器中,充入l mol CO2和4mol H2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如上图2所示。
CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如上图2所示。
①从反应开始到平衡,CO2的平均反应速率v(CO2)=;
H2的转化率w(H2) =。
②该反应的平衡常数表达式K=。
③下列措施中能使化学平衡向正反应方向移动的是 (填字母)。
A.升高温度
B.将CH3OH(g)及时液化抽出
C.选择高效催化剂
(3)25℃,1.01×105Pa时,16g液态甲醇完全燃烧,当恢复到原状态时,放出363.3kJ的热量,写出该反应的热化学方程式:_____________。
甲、乙、丙三种物质之间有如下转化关系: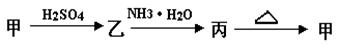
(1)若甲是不溶于水的白色固体物质,既能溶于盐酸又能溶于氢氧化钠溶液,则甲是_______ 。写出乙 丙转化的离子方程式 :________________________ 。
丙转化的离子方程式 :________________________ 。
(2)若乙溶液中加入KSCN溶液 ,有血红色出现,则甲物质是__________,乙物质的水溶液显性(“酸”或“碱”),原因是(用离子方程式表示)。
(1)铝土矿的主要成分是Al2O3·3H2O,假设杂质是Fe2O3,写出由铝土矿制备金属铝的各步骤的化学方程式。(2013年高考题片段,源于高一教材)
(2)炼铁的原料有赤铁矿(假设杂质为SiO2)、焦炭、石灰石,设备为高炉,写出炼铁时所发生的主要的化学反应方程式
(3)工业上用石英砂先煅烧制取粗硅,最后经过还原反应制取高纯硅,其反应方程式分别为:
(4)假设没有Fe,生活会
假设没有Al,生活会
假设没有Si,生活会
(1)填空:填写合理的物质的结构简式:含氢量最大的有机物是;能证明CH4是正四面体结构的有机物是;能证明苯分子中不含简单的碳碳单键和碳碳双键的有机物是;苯的同系物 : 分子式为C9H12苯环上一氯代物只有一种的是 ;检验苯和甲苯的物质是(填写物质名称)。
(2)有机化学已经学了一段时间了。如果你对哪种有机物的结构、性质、用途有独到的见解,请用精炼的积极向上的富有哲理的语言描述.示例:CH3CH2OH:李白斗酒诗百篇.或者酒壮英雄胆,酒是惹祸源。但不要写无酒不成席。
示例:苯:眼中有双键,心中无双键。或者夜阑卧听风吹雨,苯环结构入梦来。