高炉炼铁过程中发生的主要反应为
已知该反应在不同温度下的平衡 常数如下:
常数如下:

请回答下列问题:
(1)该反应的平衡常数表达式=,0(填">"、"<"或"=");
(2)在一个容积为10的密闭容器中,1000℃时加入、、、各1.0 ,反应经过l0后达到平衡。求该时间范围内反应的平均反应速率=、的平衡转化率=:
(3)欲提高(2)中的平衡转化率,可采取的措施是。
A.减少的量
B.增加的量
C. 移出部分
D.提高反应温度
E.减小容器的容积
F.加入合适的催化剂
牙齿表面由一层硬的成分Ca5(PO4)3OH的物质保护着,它在唾液中存在下列平衡:
Ca5(PO4)3OH(s)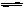 5Ca2+(aq)+3PO43-(aq) +OH-(aq)
5Ca2+(aq)+3PO43-(aq) +OH-(aq)
进食后,细菌和酶作用于食物,产生有机酸,这时牙齿就会受到腐蚀,其原因是_______
。
已知Ca5(PO4)3F的溶解度比上面的矿化物更小,质地更坚固,请用离子方程式表示,当牙膏中配有氟化物添加剂后能防止龋齿的原因_________________________。
根据以上原理请你提出另外一种促进矿化的方法_______________________。
在含有Cl-.Br-.I-的溶液中,已知其浓度均为0.1 mol/L,而AgCl.AgBr.AgI的浓度积(mol2/L2)分别为:1.6×10-10.4.1×10-15.1.5×10-16。若向混合溶液中逐滴加入AgNO3溶液并充分搅拌时,首先析出的沉淀是_______________,最后析出的沉淀是_________;当AgBr沉淀开始析出时,溶液中Ag+的浓度是___________________
向含有AgI的饱和溶液中分别加入下列物质,请就溶液中碘离子浓度的变化做出回答。(1)加入固体AgNO3:________________________________________
(2)若改加更多的AgI固体:________________________________________
(3)若改加AgBr固体:________________________________________
工程塑料ABS树脂(结构简式如下)合成时用了三种单体。
 ABS:-{-CH2-CH-CH2-CH=CH-CH2-CH2-CH-}-n
ABS:-{-CH2-CH-CH2-CH=CH-CH2-CH2-CH-}-n
CN C6H5
式中- C6H5是苯基。这三种单体的结构简式分别是:
、 、
A和B两种物质的分子式都是C7H8O,它们都能跟金属钠反应放出H2。A不与NaOH溶液反应,而B能与NaOH溶液反应。B能使适量的溴水褪色,并产生白色沉淀,A不能。B的一溴化物(C7H7BrO),有两种结构。试推断A和B的结构。并说明它们各属于哪一类有机物。
 |