某二元酸(化学式用H2A表示)在水中的电离方程式是:
H2A====H++HA- HA- H++A2-
H++A2-
完成以下问题:
(1)Na2A溶液显__________________(填“酸性”“中性”或“碱性”),理由是__________________________________________(用离子方程式表示)。
(2)已知0.1 mol·L-1的NaHA溶液pH=2,则0.1 mol·L-1的H2A溶液中氢离子的物质的量浓度_________0.11 mol·L-1(填“>”“=”或“<”)。
(3)0.1 mol·L-1 Na2A溶液中各种离子浓度由大到小的顺序是:________________________。
聚合硫酸铝铁[AlaFeb(OH)m(SO4)n·xH2O] 是一种新型高效净水剂,广泛应用于工业污染水的处理。
(1)聚合硫酸铝铁能够净水的原因是。
(2)AlaFeb(OH)m(SO4)n·xH2O中a、b、m、n的代数关系式为。
(3)为了测定聚合硫酸铝铁的组成,进行如下实验:
步骤一:准确称取8.810 g样品溶于150mL 0.100mol·L-1稀硫酸,恰好完全反应后,加入BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体10.485g;
步骤二:另取相同质量的样品,溶于过量的氢碘酸,以磁力搅拌机搅拌,充分反应后,以0.500 mol·L-1Na2S2O3溶液滴定至浅黄色,滴入几滴淀粉溶液,再滴定至终点,消耗Na2S2O3溶液20.00mL。(已知:I2+2Na2S2O3=2NaI+Na2S4O6)
①步骤二中使用磁力搅拌器进行搅拌的目的是。
②通过计算确定聚合硫酸铝铁的化学式(写出计算过程)。
(本题15分)卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们。
(1)溴的基态原子的价电子排布图为___________。
(2)在不太稀的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的。使氢氟酸分子缔合的作用力是____________。
(3)请根据下表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是___________。
| 元素名称 |
氟 |
氧 |
溴 |
碘 |
铍 |
| 第一电离能(kJ/mol) |
1681 |
1251 |
1140 |
1008 |
900 |
(4)已知高碘酸有两种形式,化学式分别为H5IO6( )和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6_____HIO4。(填“>”、“<”或“=”)
)和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6_____HIO4。(填“>”、“<”或“=”)
(5)碘在水中的溶解度虽然小,但在碘化钾溶液中溶解度却明显增大,这是由于溶液中发生下列反应:I-+I2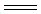
 。
。 的中心原子周围的σ键电子对对数为__________,孤电子对对数为_________。
的中心原子周围的σ键电子对对数为__________,孤电子对对数为_________。
(6)写出一个ClO2-的等电子体:_________________。
(本题13分)Ⅰ. 在一定温度下,将2molA和2molB两种气体相混合后于容积为2L的某密闭容器中,发生如下反应3A(g)+B(g) 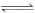 xC(g)+2D(g),2min末反应达到平衡状态,生成了0.8molD,并测得C的浓度为0.4mol/L,请填写下列空白:
xC(g)+2D(g),2min末反应达到平衡状态,生成了0.8molD,并测得C的浓度为0.4mol/L,请填写下列空白:
(1)x值等于________________。
(2)A的转化率为_________________。
(3)生成D的反应速率为_________________。
(4)如果增大反应体系的压强,则平衡体系中C的质量分数 _________。
(5)如果上述反应在相同条件下从逆反应开始进行,开始加入C和D各mol,要使平衡时各物质的质量分数与原平衡时完全相等,则还应加入________物质_________mol。
Ⅱ.恒温下,将amol N2与bmol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应:
N2(g)+3H2(g) 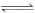 2NH3(g)
2NH3(g)
(1)若反应进行到某时刻t时,nt(N2)=13mol,nt(NH3)=6mol,则a=。
(2)反应达平衡时,混合气体的体积为716.8 L(标准状况下),其中NH3的体积分数为25%。则平衡时NH3的物质的量为。
(3)原混合气体与平衡混合气体的总物质的量之比(写出最简整数比,下同),n(始):n(平)=____________________________。
(4)达到平衡时,N2和H2的转化率之比,α(N2)∶α(H2)=________。
【化学一选修5—有机化学基础】(12分)下列有机化合物转化关系如图所示: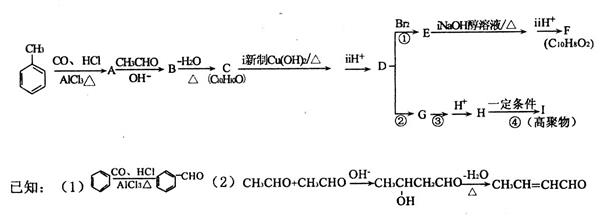
其中化合物A苯环上的一氯代物只有两种。
请回答下列问题:
(1)写出B的结构简式___________。
(2)①的反应类型为___________;化合物F的核磁共振氢谱显示有__________个峰。
(3)写出C与新制Cu(OH)2反应的化学方程式_______________。
(4)已知两分子H能形成六元环酯,反应④的化学方程式______________。
(5)化合物C有多种同分异构体,请写出满足①遇氯化铁溶液显紫色;②苯环上有三个取代基;③苯环上的一氯取代物只有两种,三种条件的所有同分异构体的结构简式______________。
【化学—选修3—物质结构与性质】(12分)过渡元素铁可形成多种配合物,如:[Fe(CN)6]4-、Fe(SCN)3等。
(1)Fe2+基态核外电子排布式为_____________。
(2)科学研究表明用TiO2作光催化剂可将废水中CN-转化为OCN-、并最终氧化为N2、CO2。OCN-中三种元素的电负性由大到小的顺序为_______________。
(3)与CN-互为等电子体的一种分子为________________(填化学式);l mol Fe(CN)63-中含有σ键的数目为________________。
(4)铁的另一种配合物Fe(CO)5熔点为-20.5℃,沸点为103℃,易溶于CCl4,据此可以判断Fe(CO)5晶体属于_______________(填晶体类型)。
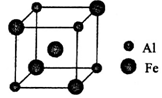
(5)铁铝合金的一种晶体属于面心立方结构,其晶胞可看成由8个小 体心立方结构堆砌而成。已知小立方体如图所示。该合金的化学式为____________。