已知某种有机物X有如下性质:①X不和碳酸氢钠反应;②X的蒸气对H2的相对密度为46.0;③取1.84 gX与过量的金属钠完全作用后,生成672 mL(标准状况)气体;④一定质量的X完全燃烧后,产生的气体依次通过浓硫酸和碱石灰,使两者的质量分别增加36.0 g和66.0 g,则X的结构简式为__________________。
右图是部分化学常见的氧化物和单质的转化关系。其中。气化物f是制造光导纤维的重要原料,氧化物c是一种具有磁性的黑色物质。回答下列问题: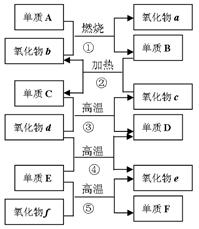
(1)写出下列物质的化学式:单质C,氧化物d;
(2)纯净的单质F在工业上的重要应用是;
(3)写出下列反应的化学方程式:
①;
④;
⑤。
复分解反应是中学化学中常见的一种反应类型。
(1)已知在常温下测得浓度均为0.1mol/L的下列6种溶液的pH值: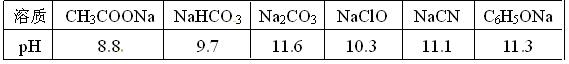 复分解存在这样一个规律:一种较强酸与另一种较弱酸的盐可以自发地反应,生成较弱酸和较强酸的盐,如:2CH3COOH+Na2CO3===2CH3COONa+CO2↑+H2O若换个角度看,它同时揭示出另一条规律,即碱性较强的物质发生类似反应可以生成碱性较弱的物质。依照该规律,请判断下列反应不能成立的是___________(填编号)。
复分解存在这样一个规律:一种较强酸与另一种较弱酸的盐可以自发地反应,生成较弱酸和较强酸的盐,如:2CH3COOH+Na2CO3===2CH3COONa+CO2↑+H2O若换个角度看,它同时揭示出另一条规律,即碱性较强的物质发生类似反应可以生成碱性较弱的物质。依照该规律,请判断下列反应不能成立的是___________(填编号)。
| A.CO2+H2O +2NaClO=Na2CO3+2HClO |
| B.CO2+H2O +NaClO=NaHCO3+HClO |
C.CO2 +H2O +C6H5ONa NaHCO3+C6H5OH NaHCO3+C6H5OH |
D.CO2 +H2O +2C6H5ONa Na2CO3+2C6H5OH Na2CO3+2C6H5OH |
E.Na2CO3+C6H5OH NaHCO3+C6H5ONa
NaHCO3+C6H5ONa
F.CH3COOH+NaCN=CH3COONa+HCN
(2)根据前述信息判断,常温下浓度均为0.05 mol/L的下列5种物质的溶液中,pH最小的是_____(填编号),其pH值为_______(填数值);pH最大的是____(填编号)。
①HCN②CH3COOH③HClO4④HClO⑤H2SO4
(3)一些复分解反应的发生还遵循其它的规律。下列转化都属于复分解反应:
①工业上将石灰乳与纯碱溶液混合可制得苛性钠溶液
②侯氏制碱法中,向饱和碳酸氢铵溶液中加入饱和食盐水可获得小苏打晶体
③蒸发KCl和NaNO3混合溶液,首先析出NaCl晶体
请根据上述反应,总结出复分解反应发生的另一规律:;
(4)根据(3)中结论,现将KI溶液和AgCl固体混合搅拌,则可能会观察到的现象是,反应的离子方程式为。
(1)配平氧化还原反应方程式:
C2O42-+MnO4-+H+=CO2+Mn2++H2O
(2)称取6.0 g含H2C2O4·2H2O、KHC2O4和K2SO4的试样,加水溶解,配成250mL溶液。量取两份此溶液各25mL,分别置于两个锥形瓶中。
①第一份溶液中加入酚酞试液,滴加0.25mol/LNaOH溶液至20mL时,溶液由无色变为浅红色。该溶液被中和的H+的总物质的量为mol。
②第二份溶液中滴加0.10mol/L的酸性高锰酸钾溶液至16mL时反应完全,此时溶液颜色由变为。该溶液中还原剂的总物质的量为mol。
③原试样中H2C2O4·2H2O的质量分数为。KHC2O4的质量分数为。
根据下列框图回答问题
(答题时,方程式中的M、E用所对应的元素符号表示):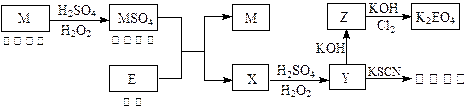
(1)写出M溶于稀H2SO4和H2O2混合液的离子方程式:。
(2)某同学取X的溶液,用稀硫酸酸化并搅拌后,加入淀粉KI溶液,溶液变为蓝色。写出与上述变化过程相关的离子方程式:、。
(3)写出Cl2将Z氧化为K2EO4的化学方程式:。
(4)由E制备出的E(C2H5)2的结构如右图,其中氢原子的化学环境完全相同。但早期人们却错误地认为它的结构为: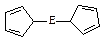 。核磁共振法能够区分这两种结构。在核磁共振氢谱中,正确的结构有种峰,错误的结构有种峰。
。核磁共振法能够区分这两种结构。在核磁共振氢谱中,正确的结构有种峰,错误的结构有种峰。
某固体混合物可能含Al、(NH4)2SO4、MgCl2、A1Cl3、FeCl2、NaCl中的一种或几种,现对该混合物作如下实验,所得现象和有关数据如图(气体体积已换算成标况下体积):
请回答:
(1)混合物中是否存在FeCl2_________(填“是”或“否”);
(2)混合物中是否存在(NH4)2SO4_____(填“是”或“否”),你的判断依据是_______。
(3)写出反应⑤的离子反应方程式;___________________________________。
(4)请根据图中数据分析,原固体混合物的成分为______________________(写化学式)。