复分解反应是中学化学中常见的一种反应类型。
(1)已知在常温下测得浓度均为0.1mol/L的下列6种溶液的pH值: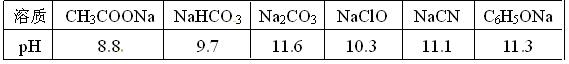 复分解存在这样一个规律:一种较强酸与另一种较弱酸的盐可以自发地反应,生成较弱酸和较强酸的盐,如:2CH3COOH+Na2CO3===2CH3COONa+CO2↑+H2O 若换个角度看,它同时揭示出另一条规律,即碱性较强的物质发生类似反应可以生成碱性较弱的物质。依照该规律,请判断下列反应不能成立的是___________(填编号)。
复分解存在这样一个规律:一种较强酸与另一种较弱酸的盐可以自发地反应,生成较弱酸和较强酸的盐,如:2CH3COOH+Na2CO3===2CH3COONa+CO2↑+H2O 若换个角度看,它同时揭示出另一条规律,即碱性较强的物质发生类似反应可以生成碱性较弱的物质。依照该规律,请判断下列反应不能成立的是___________(填编号)。
| A.CO2+H2O +2NaClO=Na2CO3+2HClO |
| B.CO2+H2O +NaClO=NaHCO3+HClO |
C.CO2 +H2O +C6H5ONa NaHCO3+C6H5OH NaHCO3+C6H5OH |
D.CO2 +H2O +2C6H5ONa Na2CO3+2C6H5OH Na2CO3+2C6H5OH |
E.Na2CO3+C6H5OH NaHCO3+C6H5ONa
NaHCO3+C6H5ONa
F.CH3COOH+NaCN=CH3COONa+HCN
(2)根据前述信息判断,常温下浓度均为0.05 mol/L的下列5种物质的溶液中,pH最小的是_____(填编号),其pH值为_______(填数值);pH最大的是____(填编号)。
①HCN ②CH3COOH ③HClO4 ④HClO ⑤H2SO4
(3)一些复分解反应的发生还遵循其它的规律。下列转化都属于复分解反应:
①工业上将石灰乳与纯碱溶液混合可制得苛性钠溶液
②侯氏制碱法中,向饱和碳酸氢铵溶液中加入饱和食盐水可获得小苏打晶体
③蒸发KCl和NaNO3混合溶液,首先析出NaCl晶体
请根据上述反应,总结出复分解反应发生的另一规律: ;
(4)根据(3)中结论,现将KI溶液和AgCl固体混合搅拌,则可能会观察到的现象是 ,反应的离子方程式为 。
常温下,0.1m01/L的下列溶液:
①HCl、②CH3COOH、③CH3COONa、④NaOH、⑤FeCl3、⑥NaCl。
(1)pH由小到大排列顺序为(填序号);
(2)实验室配制⑤的溶液时常需加入少量盐酸,否则得到的是浑浊的溶液,产生浑浊的原因是(用离子方程式表示)
(3)物质的量浓度相同的①氨水②氯化铵③碳酸氢铵④硫酸氢铵⑤硫酸铵
在上述五种溶液中,铵根离子物质的量浓度由大到小的顺序是
(4)已知拆开1molH—H键,1molN—H键,1molN≡N键分别需要的能量是436kJ、39l kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式为
下表是A、B、C、D、E五种有机物的有关信息:
| A |
①能使溴的四氯化碳溶液褪色; ②比例模型为  ③能与水在一定条件下反应生成C |
| B |
①由C、H两种元素组成; ②球棍模型为 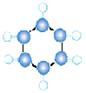 |
| C |
①由C、H、O三种元素组成; ②能与Na反应; ③与E反应生成相对分子质量为88的酯 |
| D |
①相对分子质量比C少2; ②能由C催化氧化得到 |
| E |
①由C、H、O三种元素组成; ②其水溶液能使紫色石蕊试液变红 |
回答下列问题:
(1)A~E中,属于烃的是(填字母)。
(2)A能使溴的四氯化碳溶液褪色,发生反应的化学方程式为。
(3)C催化氧化生成D的化学方程式为 ____________________。
(4)有机物B具有的性质是(填序号)。
①无色无味的液体;②有毒;③不溶于水;④密度比水大;⑤能使酸性KMnO4溶液和溴水褪色
(5)E的水溶液能使紫色石蕊试液变红,说明E的水溶液显酸性,现设计一个实验来比较E与碳酸酸性的强弱,则该实验的原理是(用化学方程式说明)。
(Ⅰ)某烃A的相对分子质量为84。回答下列问题:
(1)下列物质与A以任意比例混合,若总物质的量一定,充分燃烧消耗氧气的量不相等的是(填序号)________。
a.C7H12O2b.C6H14c.C6H14Od.C7H14O3
(2)若烃A为链烃,分子中所有的碳原子在同一平面上,该分子的一氯取代物只有一种。A的结构简式为________________;
(3)若A不能使溴水褪色,且其一氯代物只有一种,则A的结构简式为______________。
(Ⅱ)1mol分子式为CmHn的有机物在氧气中完全燃烧,生成CO2和H2O的物质的量相等,并消耗168L氧气(标况下)。该有机化合物的分子式____ _____;
(Ⅲ)某有机物A是烃的含氧衍生物,为测定其组成有如下实验结果:
①在一定温度和压强下将A汽化,其质量是同温、同压下氢气质量的76倍;
②称取7.6g有机物A,在过量氧气中完全燃烧。将反应后的混合气体通过足量浓H2SO4后体积变为10.64L,浓硫酸增重3.6g。再将余下的气体通过盛有足量碱石灰的干燥管,气体体积减少至1.68L(气体体积均在标准状况下测定)。确定A的分子式。
德国化学家凯库勒认为苯分子的结构中,碳碳间以单、双键交替结合而成环状。为了评价凯库勒的观点,某学生设计了以下实验方案:
①按下图所示的装置图连接好各仪器;②检验装置的气密性;
③在A中加入适量的苯和液溴的混合液体,再加入少量铁粉,塞上橡皮塞,打开K1、K2、K3止水夹;
④待烧瓶C中气体收集满后,将导管D的下端插入烧杯里的水中,关闭K2,打开K3,挤压预先装有水的胶头滴管的胶头,观察实验现象。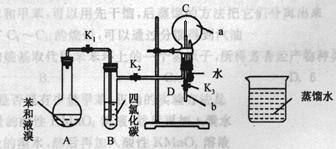
试回答:
(1)A中所发生的反应的反应类型为,能证明凯库勒观点错误的实验现象是;
(2)装置B的作用是 ;
(3) 写出A中发生反应的化学方程式;
(4)实验前应对A、B、C三个装置的气密性进行检查,则检查装置C的气密性的操作为
。
在某化学反应中,反应混合物A、B、C的物质的量浓度(mol·L—1)与时间t(s)关系如表所示。
| t(s) |
200 |
400 |
800 |
| c(A)(mol·L—1) |
1.45 |
1.28 |
1.00 |
| c(B)(mol·L—1) |
0.38 |
0.72 |
1.28 |
| c(C)(mol·L—1) |
0.095 |
0.18 |
0.32 |
(1)该反应的化学方程式为。
(2)用A浓度变化表示200~800 s内反应的平均反应速率为mol/(L·min)。
(3)用C浓度变化表示400~800 s内反应的平均反应速率为 mol/(L·s)。