下表是A、B、C、D、E五种有机物的有关信息:
| A |
①能使溴的四氯化碳溶液褪色; ②比例模型为  ③能与水在一定条件下反应生成C |
| B |
①由C、H两种元素组成; ②球棍模型为 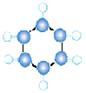 |
| C |
①由C、H、O三种元素组成; ②能与Na反应; ③与E反应生成相对分子质量为88的酯 |
| D |
①相对分子质量比C少2; ②能由C催化氧化得到 |
| E |
①由C、H、O三种元素组成; ②其水溶液能使紫色石蕊试液变红 |
回答下列问题:
(1)A~E中,属于烃的是 (填字母)。
(2)A能使溴的四氯化碳溶液褪色,发生反应的化学方程式为 。
(3)C催化氧化生成D的化学方程式为 ____________________。
(4)有机物B具有的性质是 (填序号)。
①无色无味的液体;②有毒;③不溶于水;④密度比水大;⑤能使酸性KMnO4溶液和溴水褪色
(5)E的水溶液能使紫色石蕊试液变红,说明E的水溶液显酸性,现设计一个实验来比较E与碳酸酸性的强弱,则该实验的原理是 (用化学方程式说明)。
A、B、C、D、E、F的原子序数依次增大,它们都是同周期的元素。已知:A、C、F
三种原子最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水;D元素原子的最外层电子数比次外层电子数少4;E元素原子次外层电子数比最外层电子数多3。
(1)写出下列元素的符号:A____________,B____________,E____________。
(2)B的单质在F的单质中燃烧的现象是____________,化学方程式是__。
(3)A、C两种元素的最高价氧化物的水化物反应的离子方程式是_______
1971年美国的斯图杰尔和阿佩里曼在0℃ 以下将氟气从细冰末上通过,成功地合成了一直认为不存在的氟的含氧酸——次氟酸。
(1)写出次氟酸的结构并指出各元素的化合价__________________;
(2)次氟酸刹那间被热水分解得到既可表现氧化性 (对NaI)又可表现还原性(对KMnO4)的溶液,写出反应的化学方程式______________________________________。
1999年是人造元素丰收年,一年间得到第114、116和118号三个新元素。按已知的原子结构规律,118号元素应是第______周期第______族元素,它的单质在常温常
压下最可能呈现的状态是_______(气、液、固选一填入)。近日传闻俄罗斯合成了第
166号元素,若已知原子结构规律不变,该元素应是第_________周期第________元素。
由 H、
H、 H、
H、 H、
H、 Cl、
Cl、 Cl组成的氯化氢分子中,用精密的仪器检测这些分子,可测出____________种氯化氢分子,氯化氢分子的式量有________种。
Cl组成的氯化氢分子中,用精密的仪器检测这些分子,可测出____________种氯化氢分子,氯化氢分子的式量有________种。
A、B、C为短周期元素,在周期表中所处的位置如图所示,A、C两种元素的原子外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等,请回答下列问题
(1)写出A、B、C三种元素的名称A,B,C。
(2)B位于周期表中周期族
(3)C的原子结构示意图为 C的单质与水反应的化学方程式为
(4)比较B、C的原子半径为>,写出A的气态氢物与B的最高价氧化物对应的水化物反应的化学方程式