(15 分) 亚氯酸钠(NaClO2)是一种重要的消毒剂,主要用于水、砂糖、油脂的漂白与杀菌。以下是制取亚氯酸钠的工艺流程: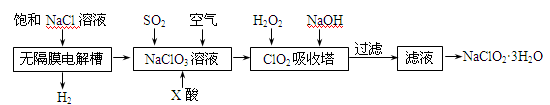
已知:①NaClO2的溶解度随着温度升高而增大,适当条件下可结晶析出。
②ClO2气体只能保持在稀释状态下以防止爆炸性分解,且需现合成现用。
③ClO2气体在中性和碱性溶液中不能稳定存在。
(1)在无隔膜电解槽中持续电解一段时间后,生成氢气和NaClO3,请写出阳极的电极反应方程式: 。
(2)反应生成ClO2气体需要X酸酸化的原因为: 。X酸为 。
(3)吸收塔内的温度不能过高的原因为:
(4)吸收塔内ClO2随着还原剂的不同和溶液酸碱性的变化可被还原为ClO2—或Cl—。ClO2被S2—还原为ClO2—、Cl—的转化率与溶液pH的关系如右图所示。
请写出pH≤2时ClO2与S2—反应的离子方程式: 。
(5)第二步向NaClO3溶液中通SO2的同时通入空气的原因为: 。
(6)从滤液中得到NaClO2·3H2O粗晶体的操作步骤为
、 、 。
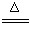
实验室用氨气还原氧化铜的方法测定铜的近似相对原子质量,反应的化学方程式为 
试回答:
(1)如果选用测定反应物CuO和生成物H2O的质量(m(CuO)、m(H2O))时,请用下列仪器设计一个简单的试验方案。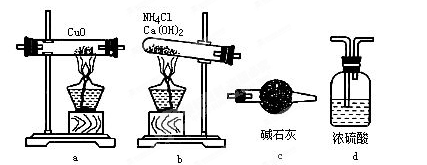
① 仪器连接的顺序(用字母编号表示,仪器可重复使用)_________;
d中浓硫酸的作用是________,______;
实验完毕时观察到a中的现象是__________;
② 列出计算Cu的相对原子质量的表达式_________;
③ 下列情况将使测定结果偏大的是________。(以下选择填空不限1个正确答案,均用字母编号填写)
A. CuO未全部还原为Cu
B. CuO受潮
C. CuO中混有Cu
(2)如果仍采用上述仪器装置,其它方案可选用测定的物理量有_______
A. m(Cu)和m(CuO) B. m(N2)和m(H2O)
C. m(Cu)m(H2O) D. m(NH3)和m(H2O)
某学生设计了三个实验方案,用以检验淀粉的水解情况。
⑴方案甲:淀粉液 水解液
水解液 中和液
中和液 溶液变蓝
溶液变蓝
结论:淀粉没有水解
⑵方案乙:淀粉液 水解液
水解液 无红色沉淀
无红色沉淀
结论:淀粉没有水解
⑶方案甲:淀粉液 水解液
水解液 中和液
中和液 有红色沉淀
有红色沉淀
结论:淀粉已水解
以上三种方案的设计及结论是否正确?如不正确,请简述理由。
实验室里用一般的气体发生装置来制备Cl2,反应物即使在停止加热后反应还会继续一段时间,当要收集多瓶Cl2时,常有较多的Cl2逸散到空气中去,为了避免Cl2的逸散,并对多余的Cl2随时取用,有人设计了如下图的甲装置来制取Cl2: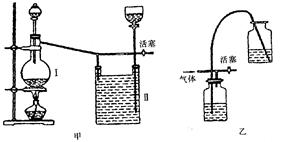
(1)设计甲装置是依据了(填已学某仪器名称)的原理。甲中装置
Ⅱ(填能或不能)用乙装置来代替。
(2)甲中Ⅱ中盛有的液体是,该装置可看作是一个(填某仪器名称),简述其主要原理:
实验室里用下图所示装置制取纯净的无水CuCl2。试回答下列问题:
(1)写出烧瓶中发生反应的化学方程式,并标出电子转移的方向和数目。
(2)B处盛有饱和食盐水(或水),其作用是。
(3)C处盛放的试剂__________(填名称),其作用是。 (4)E处盛有___________(填名称),发生反应的离子方程式为_________。
(4)E处盛有___________(填名称),发生反应的离子方程式为_________。
(5)实验结束时,应先熄灭__________处酒精灯。
“碘钟”实验中,3I-+S2O82-=I3-+2SO42-的反应速率可以用I3-与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20℃进行实验,得到的数据如下表:
| 实验编号 |
① |
② |
③ |
④ |
⑤ |
| c(I-)/mol·L- |
0.040 |
0.080 |
0.080 |
0.160 |
0.120 |
| c(SO42-)/mol·L- |
0.040 |
0.040 |
0.080 |
0.020 |
0.040 |
| t /s |
88.0 |
44.0 |
22.0 |
44.0 |
t2 |
回答下列问题:
(1)该实验的目的是。
(2)显色时间t2=。
(3)温度对该反应的反应速率的影响符合一般规律,若在40℃下进行编号③对应浓度的实验,显色时间t2的范围为(填字母)
A <22.0sB22.0~44.0sC>44.0sD数据不足,无法判断
(4)通过分析比较上表数据,得到的结论是。