(14 分)过氧化氢和臭氧都是常见的绿色氧化剂,在工业生产中有着重要的用途。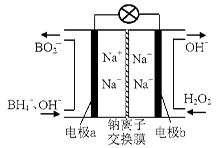
(1)据报道以硼氢化合物NaBH4(B的化合价为+3价)和H2O2作原料的燃料电池,可用作通信卫星电源。负极材料采用Pt/C,正极材料采用MnO2,其工作原理如右图所示。该电池放电时正极的电极反应式为: ;
以MnO2做正极材料,可能是因为 。
(2)火箭发射常以液态肼(N2H4)为燃料,液态过氧化氢
为助燃剂。已知:
N2H4(g) + O2(g) = N2(g) + 2H2O(g) △H =" –" 534 kJ·mol-1
H2O2(l) = H2O(l) + 1/2O2(g) △H =" –" 98.64 kJ·mol-1
H2O(l) = H2O(g) △H=" +" 44kJ·mol-1
则反应N2H4(g) + 2H2O2(l) = N2(g) + 4H2O(g) 的△H= 。
(3)O3 可由臭氧发生器(原理如右图所示)电解稀硫酸制得。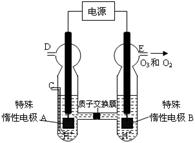
② 图中阴极为 (填“A”或“B”)。
②若C处通入O 2,则A极的电极反应式为: 。
③若C处不通入O 2 ,D、E处分别收集到15.68L和有6.72L气体(标准状况下),则E处收集的气体中O2和O3的体积之比为 (忽略 O 3 的分解)。
(4)新型O3氧化技术对燃煤烟气中的NOx和SO2脱除效果显著,锅炉烟气中的NOx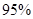 以上是以NO形式存在的,可发生反应NO(g)+ O3 (g)
以上是以NO形式存在的,可发生反应NO(g)+ O3 (g)  NO2(g)+ O2 (g)。在一定条件下,将NO和O3通入绝热恒容密闭容器中发生上述反应 ,正反应速率随时间变化的示意图(如下图)所示。由图可得出的正确说法是
NO2(g)+ O2 (g)。在一定条件下,将NO和O3通入绝热恒容密闭容器中发生上述反应 ,正反应速率随时间变化的示意图(如下图)所示。由图可得出的正确说法是 
a.反应在c点达到平衡状态
b.反应物浓度:b点小于c点
c.该反应为放热反应
d.Δt1=Δt2时,NO的转化量:a~b段小于b~c段
(1)写出下列工业生产过程所涉及的主要化学方程式:
①用铝热法炼铁____________________________________________________
②电解法冶炼铝______________________________________________________
③湿法炼铜______________________________________________________
(2)海水中含有氯化镁,是镁的重要来源之一。从海水中制取镁,某同学设计了如下步骤:
①把贝壳制成石灰乳
②直接往海水中加石灰乳,沉降、过滤、洗涤沉淀物
③将沉淀物与盐酸反应,结晶、过滤、干燥产物
④将得到的产物熔融后电解。
下列说法不正确的是__________________(填代号)
| A.此法的优点之一是原料来源丰富 |
| B.进行①②③步骤的目的是从海水中提取氯化镁 |
| C.第④步电解制镁是由于镁是很活泼的金属 |
| D.以上制取镁的过程中涉及的反应有分解反应、化合反应和置换反应 |
步骤②不够合理,理由是
。
下列物质的转化或分离是用哪种方法实现的?
| A.溶解 | B.裂解 | C.分馏 | D.裂化 E.干馏 |
F.蒸馏 G.电解 H.过滤 I.萃取
请将所选方法的字母代号填在横线上(每一项只填写一种最主要的方法)。
(1)把煤转化为焦炉气、煤焦油和焦炭等
(2)从原油中分离出汽油、煤油、柴油等
(3)将海水淡化
(4)除去粗盐溶液中的泥沙
(5)从海水得到的无水MgCl2中提取金属镁
(6)海水提溴获得的溴水中,提取溴单质
共12分) 下图中,A为芳香化合物,苯环上有两个邻位取代基: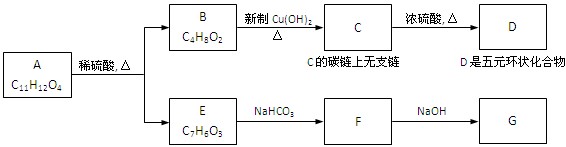
请回答:
(1)、B所含的官能团的名称是
(2)、反应C→D的化学方程式是
反应类型是
(3)、A的结构简式是、E的结构简式是
(4)、C在一定条件下可生成一种高分子化合物H,请写出C→H的化学方程式:
。
(5)、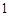 mol G的溶液可跟mo1CO2反应
mol G的溶液可跟mo1CO2反应
(6)、B有多种同分异构体,写出属于酯类且能发生银镜反应的同分异构体的结构简式
。
(共8分) 有机物A为绿色荧光蛋白在一定条件下水解的最终产物之一,结构简式为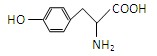
请回答下列问题:
(1)、关于A的性质推断错误的是 ;
a.A既能和酸反应又能和碱反应 b.A不能发生加成反应
c.A可以发生氧化反应 d.A不能通过缩聚反应得到高分子化合物
(2)、A与氢氧化钠溶液反应的化学方程式为 ;
(3)、符合下列4个条件A的同分异构体有 种;
① 1,3,5-三取代苯; ② 遇氢氧化铁溶液显紫色;
③ 氨基与苯环直接相连; ④ 属于酯类
(4)、写出符合上述题意的任意一种A的同分异构体的结构简式。
(共12分) 工业上以锂辉石(Li2O·Al2O3·4SiO2,含少量Ca、Mg元素)为原料生产碳酸锂。其部分工艺流程如下: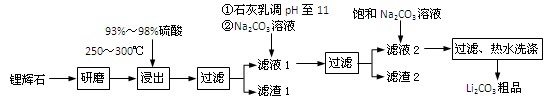
已知:① Li2O·Al2O3·4SiO2 H2SO4(浓)
H2SO4(浓)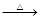 Li2SO4
Li2SO4 Al2O3·4SiO2·H2O↓
Al2O3·4SiO2·H2O↓
② 某些物质的溶解度(S)如下表所示:
| T/℃ |
20 |
40 |
60 |
80 |
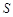 (Li2CO3)/g (Li2CO3)/g |
1.33 |
1.17 |
1.01 |
0.85 |
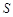 (Li2SO4)/g (Li2SO4)/g |
34.2 |
32.8 |
31.9 |
30.7 |
③ 从滤渣1中分离出Al2O3的部分流程如下图所示:
(1)、请依次写出在括号内加入试剂的化学式 、 。
(2)、请依次写出方框中所得到物质的化学式 、 。
(3)、步骤Ⅰ中反应的离子方程式是 。
(4)、已知滤渣2的主要成分有Mg(OH)2和CaCO3。向滤液1中加入石灰乳的作用是(运用化学平衡原理简述) 。
(5)、向滤液2中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是
。
(6)、氧化铝在工业上用作高温耐火材料,制耐火砖、坩埚、瓷器、人造宝石等,同时氧化铝也是炼铝的原料。写出用氧化铝炼铝的化学方程式: 。