某兴趣小组同学对实验室制取氧气的条件进行如下探究实验.
(1)为探究催化剂的种类对氯酸钾分解速度的影响,甲设计以下对比试验:
I.将3.0gKClO3与1.0gMnO2均匀混合加热
II.将xgKClO3与1.0gCuO均匀混合加热
在相同温度下,比较两组实验产生O2的快慢.
①II中x的值为 .
②若要证明CuO能作为KClO3分解的催化剂,则还要证明在化学反应前后CuO的 和 都不改变.
(2)乙探究了影响双氧水分解速度的某种因素,实验数据记录如表:
| |
双氧水的质量 |
双氧水的浓度 |
MnO2的质量 |
相同时间内产生O2的体积 |
| I |
50.0g |
1% |
0.1g |
9mL |
| II |
50.0g |
2% |
0.1g |
16mL |
| III |
50.0g |
4% |
0.1g |
31mL |
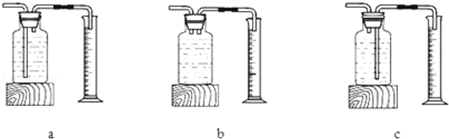
①若用上述装置测生成氧气的体积,则用图 (填“a”“b”或“c”)
②实验结论:在相同条件下, ,双氧水分解得快.
如图为电解水实验装置图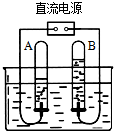
(1) 其中A试管与电极的__________极相连,B试管与电极的__________极相连,A试管中收集到的气体是___________,B试管中的气体检验方法为_________________,
(2)电解水的符号表达式_______________________
(3)该实验得出的结论_________________________
如图是常用的实验装置:

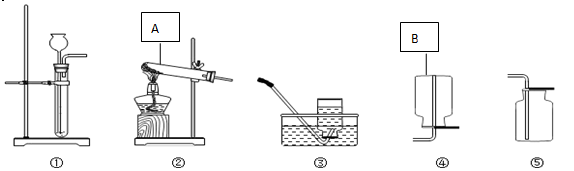
(1)写出仪器标号名称:A ___________ B _____________
(2) 在实验室中用过氧化氢溶液制取氧气,发生装置选择_________(填序号,下同),收集装置应选择______________,反应的文字表达式为___________________
(3)若用高锰酸钾制取氧气,应选择的发生装置为____________,该装置中还缺少______________,该反应的文字表达式_______________________
(4)若氯酸钾的方法制取氧气,应选择的发生装置为_____________,该反应文字表达式______________,该反应为__________反应
将下列物质按要求分类(填序号)
①空气 ② 液氧 ③ 水蒸气 ④ 锰酸钾 ⑤ 红磷 ⑥ 冰水混合物 ⑦自来水 ⑧ 过氧化氢溶液 ⑨ 二氧化硫 ⑩ 氢气
属于混合物的是_____________________
属于纯净物的是__________________
属于单质的是_________________
属于化合物的是__________________
属于氧化物的是______________________
结合下列图示回答问题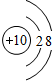
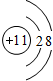
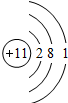
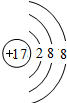
A B C D
在A、B、 C、 D四个结构示意图中,达到稳定结构的是__________,属于同种元素的是____________
属于阳离子的是_________,属于阴离子的是__________属于原子的是___________
用化学符号填空
2个氢原子_______________二氧化碳_________________5个硫离子______________
保持水化学性质的最小粒子_______________地壳中含量最多的金属元素_____________
密度最小的气体______________