NA表示阿伏加德罗常数,下列说法正确的是( )
| A.1mol/L Na2CO3溶液中的 Na+ 数目为2NA |
| B.标准状况下,11.2LSO3所含分子数为0.5NA |
| C.1 mol Na与足量O2反应生成Na2O或Na2O2均失去NA电子 |
| D.各5.6 g铁分别与足量的盐酸、氯气反应,电子转移总数均为0.3NA |
A1-H2O2电池功率大,可作为许多机械的动力电池,其结构如图所示。下列说法不正确的是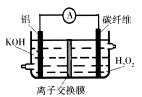
| A.铝作负极,电池工作时将不断溶解 |
| B.该电池不是二次电池,不可充电 |
| C.碳纤维电极的电极反应是H2O2+2 e一+2H+ =" 2" H2O |
| D.电池工作时OH一从碳纤维电极透过离子交换膜移向Al电极 |
短周期元素X、Y、Z、Q在元素周期表中的相对位置如下图:地壳中含量最大的三种元素已包含其中。关于这些元素的叙述不合理的是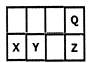
| A.最高价氧化物对应水化物的酸性Z>Y |
| B.原子半径X>Y |
| C.一定条件下,Q可分别与X、Y、Z形成化合物,这些化合物都可溶于NaOH溶液 |
| D.元素Y的氧化物是形成酸雨的罪魁祸首 |
下列离子反应方程式正确的是
| A.金属钠投入蒸馏水2 Na+2H2O=2 Na++2OH- +H2↑ |
| B.向亚硫酸钠溶液中加入足量硝酸SO3 2- +2 H+=SO2↑+ H2O |
| C.用浓盐酸与MnO2反应制取少量氯气MnO2+4H++2C1- = Mn2+ + 2H2O+Cl2↑ |
| D.硫酸亚铁溶液中加入酸化的双氧水Fe2++2H++H2O2 = Fe3++2H2O |
新型陶瓷材料氮化硅(Si3 N4)可以通过以下反应制得:3SiO2+6C+2N2 Si3N4+6CO,下列就该反应的分析错误的是
Si3N4+6CO,下列就该反应的分析错误的是
| A.压强增大,平衡向逆反应方向移动 |
| B.SiO2是氧化剂,CO是氧化产物 |
| C.上述反应若为放热反应,升高温度,平衡常数将减小 |
| D.上述反应中每生成1 molSi3N4,氮元素得12mol电子 |
处于平衡状态的反应2 H2 S(g)  2H2(g)+S2(g)
2H2(g)+S2(g) 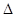 H>0,不改变其他条件的情况下合理的说法是
H>0,不改变其他条件的情况下合理的说法是
A.加入催化剂,反应途径将发生改变,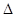 H也将随之改变 H也将随之改变 |
| B.升高温度,正逆反应速率都增大,H2S分解率也增大 |
| C.增大压强,平衡向逆反应方向移动,将引起体系温度降低 |
| D.若体系恒容,注人一些H2后达新平衡,H2浓度将减小 |