有 4 瓶常用溶液:①BaCl2溶液,②NaCl 溶液,③Na2SO4 溶液,④CuSO4溶液。不用其他试剂,可通过实验方法将它们一一鉴别开来,鉴别出来的先后顺序可能是
| A.①④③② | B.①③④② | C.④①③② | D.④②①③ |
有①Na2SO3溶液②CH3COOH溶液③HCl溶液各25 mL,物质的量浓度均为0.1 mol/L。下列说法正确的是()
| A.三种溶液的pH的大小顺序是①﹥②﹥③ |
| B.三种溶液稀释相同倍数,pH变化最大的是① |
| C.三种溶液中含微粒种类多少顺序是:②﹥①﹥③ |
| D.三种溶液中由水电离出c(H+)大小顺序是:③﹥②﹥① |
将浓度为0.1 mol/L Na2CO3溶液加水稀释,下列结论错误的是()
| A.水解平衡正向移动 | B.各微粒浓度均变小(除H2O外) |
| C.溶液中离子数目增多 | D.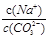 比值增大 比值增大 |
用0.1 mol/L的盐酸滴定0.1 mol/L的氨水,滴定过程中不可能出现的结果是()
A.c(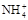 )﹥c(Cl-)﹥c(OH-)﹥c(H+) )﹥c(Cl-)﹥c(OH-)﹥c(H+) |
B.c(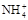 )=c(Cl-)﹥c(OH-)=c(H+) )=c(Cl-)﹥c(OH-)=c(H+) |
C.c(Cl-)﹥c(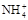 )﹥c(OH-)﹥c(H+) )﹥c(OH-)﹥c(H+) |
D.c(Cl-)﹥c(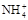 )﹥c(H+)﹥c(OH-) )﹥c(H+)﹥c(OH-) |
下列判断正确的是()
| A.pH =6的溶液一定呈酸性 |
| B.c(H+)水电离产生= c(OH-)水电离产生的溶液一定呈中性 |
| C.使石蕊试液显红色的溶液一定呈酸性 |
| D.强酸和强碱等物质的量混合后溶液一定呈中性 |
往浅绿色的Fe(NO3)2溶液中逐滴加入稀盐酸,溶液颜色的变化应该是()
| A.颜色变浅 | B.基本不变 | C.变为棕黄色 | D.变为绿色 |