短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等。下列判断不正确的是( )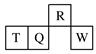
| A.最简单气态氢化物的热稳定性:R>Q |
| B.最高价氧化物对应水化物的酸性:Q<W |
| C.原子半径:T>Q>R |
| D.T的非金属性强于Q的非金属性 |
下列是某同学对相应的离子方程式所作的评价,其中评价合理的是
| 编号 |
化学反应 |
离子方程式 |
评价 |
| A |
碳酸钙与醋酸反应 |
CO32-+2CH3COOH =CO2↑+H2O+2CH3COO- |
错误,碳酸钙是弱电解质,不应写成离子形式 |
| B |
苯酚钠溶液中通入CO2 |
2C6H5O-+CO2+H2O→2C6H5OH+CO32- |
正确 |
| C |
NaHCO3的水解 |
HCO3-+H2O═CO32-+H3O+ |
错误,水解方程式误写成电离方程式 |
| D |
等物质的量的FeBr2和Cl2反应 |
2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- |
错误,离子方程式中Fe2+与Br-的物质的量之比与化学式不符 |
在离子浓度都为0.1 mol/L的下列溶液中,加入(或通入)某物质后,发生反应先后顺序正确的是
| A.在含Fe3+、Cu2+、H+的溶液中加入锌粉:Cu2+、Fe3+、H+ |
| B.在含I—、SO32—、Br—的溶液中不断通入氯气:I—、Br—、SO32— |
| C.在含Fe3+、H+、NH4+的溶液中逐滴加入烧碱溶液:Fe3+、NH4+、H+ |
| D.在含AlO2—、SO32—、OH—的溶液中逐滴加入硫酸氢钠溶液:OH—、AlO2—、SO32— |
一种新型镁铝合金的化学式为Mg17Al12,它具有储氢性能,该合金在一定条件下完全吸氢的化学方程式为:Mg17Al12+17H2=17MgH2+12Al,得到的混合物Y(17MgH2+12Al)在一定条件下能释放出氢气。下列说法正确的是
| A.该合金的熔点介于金属镁和金属铝熔点之间 |
| B.该合金中镁元素呈负价,铝元素呈正价 |
| C.1mol Mg17Al12完全吸氢后得到的混合物Y与盐酸完全反应释放出H2,若消耗盐酸的体积为14L,则该盐酸的物质的量浓度为5mol.L-1 |
| D.制备该合金应在氮气保护下,将一定比例的Mg、Al单质在一定温度下熔炼而获得 |
在FeCl3、CuCl2混合溶液中,加入一定量的铁屑,反应完全后将固体滤出,下列说法中正确的是
| A.若滤出的固体中只有铜,则溶液中一定含有的阳离子是Fe2+,一定不含Cu2+ |
| B.若滤出的固体中只有铜,则溶液中一定含有的阳离子是Fe2+,可能含Cu2+和Fe3+ |
| C.若滤出的固体中含有铁和铜,则溶液中一定含有的阳离子是Fe2+,一定不含Cu2+和Fe3+ |
| D.若滤出的固体中只有铜,则溶液中一定含有的阳离子是Fe3+和Fe2+,一定不含Cu2+ |
下列有关物质分类或归类正确的是
①混合物:盐酸、氯水、水银②化合物:CaCl2、NaOH、HD
③电解质:胆矾、冰醋酸、氯化银④同素异形体:C60、金刚石、石墨
⑤放热反应:盐酸与氢氧化钠、碳与二氧化碳高温化合成一氧化碳、甲烷燃烧
| A.①③ | B.②③ | C.③④ | D.④⑤ |