某化学学习小组为比较镁和铝的金属活动性强弱设计了如下实验方案。
(1)实验准备:(1)用98%的浓硫酸配制l0%的硫酸溶液。现有烧杯、玻璃棒、量筒, 还需要的仪器有 ;
【方案一】在等质量的镁条和铝片的两支试管中,分别与相同体积相同质量分数的硫酸反应,观察到镁比铝反应更剧烈,说明 。
[反思]:有的同学认为这种方案不够合理,理由是_________________________________。
【方案二】(1)连接仪器组装成如右图所示实验装置。某学生用抽拉法检查该装置的气密性,发现被拉出的针筒活塞一段时间后又回到原来的位置,你认为该装置是否漏气? 。
(2)依次进行镁、铝与硫酸反应,写出镁与硫酸反应的化学方程式: ;
要比较两种金属活动性强弱,可以测定两种金属硫酸反应得到相同体积氢气所需要的时间;还可测定 。
[拓展] 镁与铝分别与足量的质量分数为l0%稀硫酸反应,如制得相同质量的氢气,则镁与铝的质量比为 。(2分)
【方案三】请设计一个与上述实验不同的方案,比较镁和铝的金属活动性强弱:
小红为大家做了一个“燃纸成铁”的趣味实验。将一张滤纸(组成元素为C、H、O)用FeCl3浓溶液润湿,在酒精灯上烘干后点燃,滤纸变黑、红热,最终生成黑褐色物质。小红告诉大家:黑褐色物质中含有铁单质。
【提出问题】黑褐色物质中真的含有铁单质吗?
【探究过程】
(1)小红先从反应物组成分析,因为 所以反应后可能生成铁单质。
(2)为获得实验证据,小红做了实验1。
实验1:将黑褐色物质放入稀盐酸中,发现有连续微小气泡产生。若黑褐色物质中
含有铁单质,则反应的化学方程式为 。
(3)小明提出疑问:实验1中产生的气泡也可能是滤纸碳化后吸附的空气。为此,小红又做了实验2: 观察到有微小气泡产生但很快停止。
证明实验1中的连续气泡确实是由铁单质与稀盐酸反应产生的。
(4)为进一步证明黑褐色物质中有铁单质,小红又做了实验3。
实验3:将黑褐色物质放入 溶液中,观察到红色物质生成。
【得出结论】通过以上实验探究,证明黑褐色物质中确实含有铁单质。
(5)【实验反思】小红所做实验1和实验2是运用了实验,使结论更有说服力。
为检测某化工厂排放的废液中是否含有SO42-,同学们设计了如下方案,并进行了实验。
| 方案 |
步骤 |
现象 |
结论 |
| Ⅰ |
①取样品,滴加BaCl2溶液 ②对步骤①反应后的混合物进行过滤,在滤渣中滴加稀盐酸 |
①有白色沉淀产生 ②无明显现象 |
废液中含有SO42﹣ |
| Ⅱ |
①取样品,滴加过量_____________ ②在步骤①的溶液中滴加BaCl2溶液 |
①无明显现象 ②有白色沉淀产生 |
废液中含有SO42- |
| Ⅲ |
①取样品,滴加Ba(NO3)2溶液 ②对步骤①产生的混合物进行过滤,在滤渣中滴加稀硝酸 |
①有白色沉淀产生 ②无明显现象 |
废液中含有SO42- |
(1)方案Ⅱ的实验结论如果正确,步骤①中滴加的物质是 。21世纪教育网
(2)方案Ⅰ和Ⅲ中,结论不成立的方案是 ,理由是 。
(3)方案Ⅲ的滤渣中,滴加稀硝酸是为了排除 的干扰。
在学习过程中,可以判断反应发生的方法有多种。
(1)向盛有10mL稀盐酸的烧杯中加入氢氧化钠溶液,用pH计(测pH的仪器)测定溶液的pH,所得数据如下:
| 加入NaOH溶液的体积/mL |
0 |
2 |
4 |
6 |
8 |
10 |
12 |
14 |
| 烧杯中溶液的pH |
1.1 |
1.2 |
1.4 |
1.6 |
2.0 |
7.0 |
11.0 |
12.2 |
当加入氢氧化钠溶液的体积为mL时,稀盐酸和氢氧化钠溶液恰好完全反应。
(2)在图的实验中,当观察到的现象是 就可证明NaOH与HCl发生了反应。
(3)不使用指示剂或pH试纸等方法,也可证明反应发生。向稀盐酸和氢氧化钠混合后的溶液中加入一种物质,若没有明显现象出现,说明溶液失去了酸性,从而证明稀盐酸和氢氧化钠已经发生了反应,则该合理的物质是 。
小佳在实验室中发现一种黑色粉末和一瓶标签破损的无色溶液(如图所示),她取少量黑色粉末与溶液混合,发现立即产生了大量无色的气泡。
已知:稀硫酸(H2SO4)+Fe→硫酸亚铁(FeSO4)+H2
(1)对这两种物质是什么她进行了大胆猜想。小佳的猜想可能是:
猜想①;
猜想②稀硫酸(H2SO4)和铁粉;理由是。
(2)请你帮助小佳同学完成实验,以证明猜想①是正确的。
| 实 验 步 骤 |
实 验 记 录 |
实 验 结 论 |
| (i) 取少量黑色粉末于试管中,滴加少量无色溶液 (ii) |
(i) 有气泡产生 (ii) |
产生的气体是,发生化学反应的符号表达式为 原猜想①成立。 |
某兴趣小组同学对实验室制备氧气的条件进行如下探究实验。
①为探究催化剂的种类对氯酸钾分解速度的影响,甲设计以下对比实验:
Ⅰ.将3.0g KClO3与1.0g MnO2均匀混合加热
Ⅱ.将x g KClO3与1.0g CuO均匀混合加热在相同温度下,比较两组实验产生O2的快慢。
Ⅱ中x的值应为________。
②乙探究了影响双氧水分解速度的某种因素。实验数据记录如下:
| 双氧水的质量 |
双氧水的浓度 |
MnO2的质量 |
相同时间内产生O2体积 |
|
| Ⅰ |
50.0g |
1% |
0.1g |
9 mL |
| Ⅱ |
50.0g |
2% |
0.1g |
16 mL |
| Ⅲ |
50.0g |
4% |
0.1g |
31 mL |
本实验中,测量O2体积的装置是________(填编号)。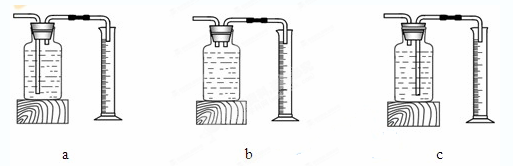
实验结论:在相同条件下,_______________,双氧水分解得越快。
丙用下图装置进行实验,通过比较____________也能达到实验目的。