已知在催化剂作用下,苯和卤代烃反应可以在苯环上引入烷烃基,生成苯的同系物。如 +HCl,现从苯出发制取十二烷基苯,再进一步制取合成洗涤剂十二烷基苯磺酸钠,分子式为
+HCl,现从苯出发制取十二烷基苯,再进一步制取合成洗涤剂十二烷基苯磺酸钠,分子式为 。
。
提供的原料除苯外,还有水、浓硫酸、十二烷、食盐及催化剂等,试用化学方程式表示此制取过程。(已知电解食盐水生成Cl2、H2和NaOH)
(1)____________________________________;
(2)____________________________________;
(3)____________________________________;
(4)____________________________________;
(5)____________________________________。
黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可以制备硫及铁的化合物。
(1)冶炼铜的反应为8CuFeS2+21O2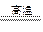 8Cu+4FeO+2Fe2O3+16SO2
8Cu+4FeO+2Fe2O3+16SO2
若CuFeS2中Fe的化合价为+2,反应中被还原的元素是 (填元素符号)。 (2)上述冶炼过程中产生大量SO2。下列处理方案合理的是 (填代号)。
(2)上述冶炼过程中产生大量SO2。下列处理方案合理的是 (填代号)。
a.高空排放
b.用于制备硫酸
c.用纯碱溶液吸收制Na2SO3
d.用浓硫酸吸收
(3)过二硫酸钾(K2S2O8)具有强氧化性,可将I-氧化为I2:
S2O82-+2I-=2SO42-+I2
通过改变反应途径,Fe3+、Fe2+均可催化上述反应。试用离子方程式表示Fe3+对上述反应的催化过程。 、 (不必配平)。
(4)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、AI2O3)可制备Fe2O3。方法为
①用稀盐酸浸取炉渣,过滤。
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得。
据以上信息回答下列问题:
a.除去Al3+的离子方程式是 。
b.选用提供的试剂,设计实验验证炉渣中含有FeO。
提供的试剂:稀盐酸稀硫酸 KSCN溶液 KMnO4溶液 NaOH溶液碘水
所选试剂为 。证明炉渣中含有的实验现象为
。
2 g Cu2S和CuS的混合物在酸性溶液中用400 mL 0.075 mol·L-1 KMnO4溶液处理,发生反应如下:
8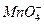 +5Cu2S+44H+====10Cu2++5SO2+8Mn2++22H2O
+5Cu2S+44H+====10Cu2++5SO2+8Mn2++22H2O 6
6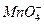 +5CuS+28H+====5Cu2++5SO2+6Mn2++14H2O
+5CuS+28H+====5Cu2++5SO2+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与350 mL 0.1 mol·L-1(NH4)2Fe(SO4)2溶液完全反应。
(1)配平KMnO4与(NH4)2Fe(SO4)2反应的离子方程式:
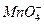 +
+ Fe2++
Fe2++ H+
H+ Mn2++
Mn2++ Fe3++
Fe3++ H2O
H2O
(2)KMnO4溶液与混合物反应后,剩余KMnO4的物质的量为_________mol。
(3)欲配制500 mL 0.1 mol·L-1 Fe2+溶液,需称取(NH4)2Fe(SO4)2·6H2O(M="392" g·mol-1)的质量为_________ g。
(4)混合物中Cu2S的质量分数为_________。
一个完整的氧化还原反应方程式可以拆开,写成两个“半反应式”,一个是“氧化反应式”,一个是“还原反应式”。如2Fe3++Cu===2Fe2++Cu2+,可拆写为氧化反应式:Cu-2e-===Cu2+,还原反应式:2Fe3++2e-="==" 2Fe2+。据此,回答下列问题:
⑴将反应Zn+2H+ ="==" Zn2++H2↑拆写为两个“半反应式”:
氧化反应式:,还原反应式:。
⑵将反应3NO2+H2O ="=" 2H++2NO3—+NO拆写为两个“半反应式”:
氧化反应式:,还原反应式:。
⑶已知某反应的两个“半反应式”为:CH4+10 OH--8e-===CO32-+7H2O,O2+2H2O+4e-="==" 4OH—,则氧化还原反应方程式为。
科学实验证明通常状态下并不存在NaAlO2,Al(OH)3溶于强碱溶液形成的阴离子实际是因为Al(OH)3分子中的铝原子最外层电子数未达到饱和,能与OH-离子形成配位键,结合生成[Al(OH)4]-,因此1molAl(OH)3与碱反应时只能中和1molH+,表现为一元酸.
(1)据此请写出Al(OH)3的两性电离的方程式____________________;
(2)硼与铝是同族元素,试推测H3BO3是_____元酸,酸性是________(强或弱);并写出其电离的方程式_____________________________;
已知电极材料:铁、铜、银、石墨、锌、铝;电解质溶液:CuCl2溶液、NaOH溶液、盐酸.按要求回答:
(1) 电工操作上规定不能把铜导线和铝导线连接在一起使用.说明原因 .
(2)若电极材料选铜和石墨,电解质溶液选硫酸铜溶液,外加导线,能否构成原电池?,若能,请写出电极反应式,负极,正极 .(若不能,后面两空不填)
(3)通常说的燃料电池都以铂为电极,将燃烧反应的化学能转化为电能,在燃料电池中,可燃物在 极反应, 在另一极反应。