下列关于浓硝酸和浓硫酸的叙述,正确的是
| A.常温下都用铜容器贮存 | B.露置在空气中,容器内酸液的质量都减轻 |
| C.常温下都能与铜较快反应 | D.露置在空气中,容器内酸液的浓度都降低 |
已知:① 2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ·mol-1 ②H2(g)+S(g)=H2S(g) ΔH=-20.1 kJ·mol-1。
下列判断正确的是()
| A.1 mol氢气完全燃烧生成液态水吸收热量241.8 kJ |
| B.1 mol H2O(g)和1 mol H2S(g)的能量相差221.7 kJ |
| C.由①②知,水的热稳定性小于硫化氢 |
| D.若反应②中改用固态硫,1 mol S(s)完全反应,放出的热量小于20.1 kJ |
反应A(g)+B(g)→C(g) ΔH,分两步进行:①A(g)+B(g)―→X(g) ΔH1 ②X(g)―→C(g) ΔH2,反应过程中能量变化如图所示,E1表示A+B―→X的活化能,下列说法正确的是()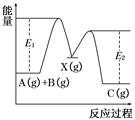
| A.ΔH1=ΔH-ΔH2>0 |
| B.X是反应A(g)+B(g)―→C(g)的催化剂 |
| C.E2是反应②的活化能 |
| D.ΔH=E1-E2 |
X、Y、Z、W是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,己是由Z元素形成的单质。已知:甲+乙=丁+己,甲+丙=戊+己; 0.1 mol·L-1丁溶液的pH为13(25 ℃)。下列说法正确的是()
| A.原子半径:W>Z>Y>X |
| B.Y元素在周期表中的位置为第3周期第ⅣA族 |
| C.1 mol甲与足量的乙完全反应共转移1 mol电子 |
| D.化合物甲中只有离子键 |
短周期元素X、Y、Z、W的原子序数依次增大,且原子最外层电子数之和为13。X的原子半径比Y的小,X与W同主族,Z是地壳中含量最高的元素。下列说法正确的是()
| A.原子半径的大小顺序:r(Y)>r(Z)>r(W) |
| B.元素Z、W的简单离子的电子层结构不同 |
| C.元素Y的简单气态氢化物的热稳定性比Z的强 |
| D.只含X、Y、Z三种元素的化合物,可能是离子化合物,也可能是共价化合物 |
已知几种短周期元素的原子半径、常见的最高价和最低价如下表,下列说法中不正确的是 ()
| 元素性质 |
元素编号 |
||||||
| ① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
|
| 原子半径(nm) |
0.073 |
0.075 |
0.152 |
0.110 |
0.099 |
0.186 |
0.143 |
| 最高正化合价 |
无 |
+5 |
+1 |
+5 |
+7 |
+1 |
+3 |
| 最低负化合价 |
-2 |
-3 |
无 |
-3 |
-1 |
无 |
无 |
A.⑦的简单离子不是同周期元素离子半径最小的
B.气态氢化物的稳定性①>②
C.②的气态氢化物浓溶液可用于检验氯气管道的泄漏
D.阴离子的还原性④大于⑤,最高价氧化物的水化物的碱性③小于⑥