已知:体系的自由能变化ΔG=ΔH-TΔS<0时,反应能自发进行。下列反应中,一定不能自发进行的是( )
| A.2KClO3(s)=2KCl(s)+3O2(g) ΔH=-78.03kJ/mol ΔS="1110" J/(mol·K) |
| B.CO(g)=C(s,石墨)+1/2O2(g) ΔH=110.5kJ/mol ΔS="-89.36" J/(mol·K) |
| C.4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s) ΔH=-444.3kJ/molΔS="-280.1" J/(mol·K) |
| D.NH4HCO3(s)+CH3COOH(aq)=CO2(g)+CH3COONH4(aq)+H2O(l) |
ΔH=37.301kJ/mol ΔS="184.05" J/(mol·K)
AlCl3和MgCl2的混合溶液中,逐滴加入NaOH溶液,则消耗NaOH溶液体积(X轴)和生成沉淀(Y轴)之间的函数关系可用如图来表示,则下列关系图正确的是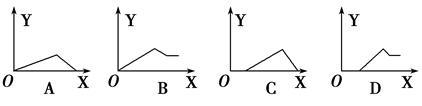
下列离子方程式书写正确的是


①向明矾溶液中加入过量的氢氧化钡溶液:Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O
②向氢氧化亚铁中加入足量的稀硝酸:Fe(OH)2+2H+=Fe2++2H2O
③向磷酸二氢铵溶液中加入足量的氢氧化钠溶液:NH4++OH-=NH3•H2O ④向CH2BrCOOH中加入足量的氢氧化钠溶液并加热:
④向CH2BrCOOH中加入足量的氢氧化钠溶液并加热:
CH2BrCOOH+OH- CH2BrCOO-+H2O
⑤向含0.5mol溴化亚铁溶液中通入0.5mol氯气2Fe2++Cl2=2Fe3++2Cl-
⑥澄清石灰水中滴加少量碳酸氢钙溶液Ca2++OH-+HCO3-=H2O+CaCO3
⑦氯化铝溶液中加入过量的氨水Al3++4NH3•H2O=AlO2-+4NH4++2H2O
⑧小苏打与甲酸溶液混合H++CO32-+HCOOH=CO2↑+HCOO-+H2O
| A.②④ | B.①⑥ | C.③⑤⑥ | D.①③⑦ |
将足量CO2通入下列各溶液中,所含离子还能大量共存的是
| A.K+、SO32-、Cl-、NO3- |
| B.H+、NH4+、Al3+、SO42- |
| C.Na+、S2-、OH-、SO42- |
| D.Na+、C6H5O-、CH3COO-、HCO3- |
为了证明(NH4)2Fe(SO4)2·6H2O(硫酸亚铁铵晶体)的成分中含有NH4+、Fe2+、SO42-和H2O,下列实验叙述中不正确的是
| A.取少量硫酸亚铁铵晶体放入试管,加热,试管口有液体生成,则可证明晶体的成分中含有结晶水 |
| B.硫酸亚铁铵晶体溶于水,得淡绿色溶液,滴入2滴KSCN溶液,溶液不显红色,再滴入几滴新制氯水,溶液变为红色,则可证明晶体的成分中含有Fe2+ |
| C.硫酸亚铁铵晶体溶于水,加少量稀盐酸,无现象,再滴入几滴BaCl2溶液,有白色沉淀生成,则可证明晶体的成分中含有SO42- |
| D.取少量硫酸亚铁铵晶体放入试管,加入少量稀NaOH溶液,在试管口用湿润的红色石蕊试纸检验,则可证明晶体的成分中含有NH4+ |
下列各组离子在指定的溶液中能大量共存的是
①无色溶液中:K+、Cu2+、Na+、SO42-
②pH=11的溶液中:CO32-、Na+、AlO2-、NO3-
③加入Al能放出H2的溶液中:Cl-、HCO3-、NO3-、NH4+
④在由水电离出的c(OH-)=10-13mol·L-1的溶液中:Na+、Ba2+、Cl-、I-
⑤能使红色石蕊试纸变为蓝色的溶液:Na+、Cl-、S2-、ClO-
⑥酸性溶液中:Fe2+、Al3+、NO3-、Cl-
| A.①②⑤ | B.③⑤⑥ | C.②④ | D.②④⑥ |