为了证明(NH4)2Fe(SO4)2·6H2O(硫酸亚铁铵晶体)的成分中含有NH4+、Fe2+、SO42-和H2O,下列实验叙述中不正确的是
| A.取少量硫酸亚铁铵晶体放入试管,加热,试管口有液体生成,则可证明晶体的成分中含有结晶水 |
| B.硫酸亚铁铵晶体溶于水,得淡绿色溶液,滴入2滴KSCN溶液,溶液不显红色,再滴入几滴新制氯水,溶液变为红色,则可证明晶体的成分中含有Fe2+ |
| C.硫酸亚铁铵晶体溶于水,加少量稀盐酸,无现象,再滴入几滴BaCl2溶液,有白色沉淀生成,则可证明晶体的成分中含有SO42- |
| D.取少量硫酸亚铁铵晶体放入试管,加入少量稀NaOH溶液,在试管口用湿润的红色石蕊试纸检验,则可证明晶体的成分中含有NH4+ |
下列离子方程式正确的是
| A.氨水与亚硫酸溶液混合:NH3·H2O+H+===NH4++H2O |
| B.将少量SO2通入Ca(ClO)2溶液中:SO2 + H2O + Ca2+ + 2ClO- =" 2HClO" +CaSO3↓ |
| C.足量铁屑溶于稀硫酸:2Fe+6H+= 2Fe3++3H2↑ |
| D.将Cl2通入FeSO4溶液中:Cl2+2Fe2+==2Fe3++2Cl- |
理论上不能设计为原电池的化学反应是
A.2H2+O2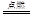 2H2O 2H2O |
B.HNO3+NaOH===NaNO3+H2O |
C.CH4+2O2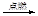 CO2+2H2O CO2+2H2O |
D.2FeCl3+Fe===3FeCl2 |
下列措施对增大反应速率明显有效的是
| A.Na与水反应时增大水的用量 |
| B.CaCO3与盐酸反应制取CO2时,改用浓硫酸 |
C.C(s)+H2O(g)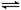 CO(g)+H2(g),将碳块改成碳粉进行实验 CO(g)+H2(g),将碳块改成碳粉进行实验 |
| D.粗锌与盐酸反应,将粗锌换成纯锌 |
①②③④四种金属片两两相连浸入稀硫酸中都可组成原电池。①②相连时,外电路电流从②流向①;①③相连时,③为正极;②④相连时,②上有气泡逸出;③④相连时,③的质量减少。
据此判断这四种金属活动性由大到小的顺序是
| A.①③②④ | B.①③④② | C.③④②① | D.③①②④ |
某短周期主族元素R的原子其电子式可用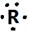 表示。该元素组成的以下物质,分子式肯定不正确的是
表示。该元素组成的以下物质,分子式肯定不正确的是
| A.最高价氧化物分子式为R2O5 | B.含氧酸分子式为 HRO3 |
| C.含氧酸分子式为H3RO4 | D.气态氢化物分子式为RH5 |