(12分) (1)某温度下,Kw=10-12。
①若保持温度不变,某溶液中c(H+)为1×10-7mol·L-1,则该溶液显 性(填“酸”、“碱”或“中”)。
②若保持温度不变,向水中通入的HCl气体恰好使溶液中c(H+)/c(OH-)=1010,则此时水电离的c(H+)= mol·L-1。
(2)常温下,如果取0.1mol/LHA溶液与0.1mol/LNaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,试回答以下问题:
①混合溶液的pH=8的原因(用离子方程式表示): 。
②混合溶液中离子浓度由大到小的顺序是: 。
③混合溶液中由水电离出的c(H+) 同浓度NaOH溶液中由水电离出的c(H+)
(填“>”、“<”或“=”)。
④求出混合溶液中下列算式的精确计算结果(填具体数据):
c(Na+)-c(A-)= mol/L。
【化学——有机化学基础】有机物N和R为高分子材料,其制取的流程如图所示:
已知: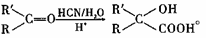
(1)反应I的反应条件是 ;化合物C的结构简式是
(2)由 的反应类型是 ,D生成E的过程中,浓硫酸的作用是
的反应类型是 ,D生成E的过程中,浓硫酸的作用是
(3)B中的含氧官能团为
(4)反应II的化学方程式为 。
(5)下列说法正确的是 (填序号)。
a、常温下,A能和水以任意比混溶
b、A可与NaOH溶液反应
c、化合物C可使高锰酸钾酸性溶液褪色
d、E存在顺反异构休
(6)反应III的化学方程式为
(7)符合下列条件的B的同分异构体有 种。
a.能与饱和溴水反应生成白色沉淀;
b.属于酯类;
c.苯环上只有两个取代基
【化学—选修3:物质结构与性质】
在元素周期表中,除稀有气体外几乎所有元素都能与氢形成氢化物
(1)氨气是共价型氢化物。工业常用氨气和醋酸二氨合铜{[Cu(NH3)2]Ac}的混合液来吸收一氧化碳(醋酸根CH3COO-简写为Ac-)。反应方程式为:[Cu(NH3)2]Ac+ CO+NH3 [Cu(NH3)3CO]Ac
[Cu(NH3)3CO]Ac
①请写出基态Cu原子的电子排布式 。
②氨水溶液中各元素原子的第一电离能从大到小排列顺序为 ,理由是 ;其中NH3应为 (填“极性”或“非极性”)分子。
③醋酸分子中的两个碳原子的化方式分别是 。
④生成物[Cu(NH3)3CO]Ac中所含化学键类型有 。(填序号)
a.离子键 b.金属键 c. 共价键 d. 配位键
(2)某离子型氢化物化学式为XY2,晶胞结构如下图所示,其中6个Y原子(○)用阿拉伯数字1~6标注。
①已知1、2、3、4号Y原子在晶胞上、下面上。则5、6号Y原子均在晶胞 。(填“侧面”或“内部”)
②根据以上信息可以推知,XY2晶体的熔沸点 (填“>”“=”“<”)固态氨的沸点。
③若该晶胞的边长为a nm,密度为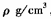 ,XY2的摩尔质量为
,XY2的摩尔质量为 ,则阿伏加德罗常数可表示为
,则阿伏加德罗常数可表示为
(1)自然界Cr主要以+3价和+6价存在。+6价的Cr能引起细胞的突变,可以用亚硫酸钠将其还原为+3价的铬。完成并配平下列离子方程式:
__Cr2O72-+__SO32-+__ =__Cr3++__SO42-+ __H2O
=__Cr3++__SO42-+ __H2O
(2)为测定NiSO4·xH2O晶体中x的值,称取26.3 g晶体加热至完全失去结晶水,剩余固体15.5 g,列式计算x的值等于 。
(3)某无色废水中可能含有H+、NH4+、Fe3+、Al3+、Mg2+、Na+、NO3-、CO32-、SO42-中的几种,为分析其成分,分别取废水样品100mL,进行了三组实验,其操作和有关图象如图所示:
请回答下列问题:
①实验中需配制1.0mol/L的NaOH溶液100mL,所需仪器除了玻璃棒、托盘天平、量筒、药匙、烧杯、胶头滴管,还缺少的仪器为
②实验③中沉淀量由A→B过程中所发生反应的离子方程式为
③根据上述3组实验可以分析废水中一定不存在的离子有: .
④分析图象,在原溶液中c(NH4+)与c(Al3+)的比值为 试确定NO3-是否存在? (填“存在”、“不存在”或“不确定”),若存在,试计算c(NO3-)= (若不存在,此问不必作答).
(1)①CaCO3(s) ="=" CaO(s) + CO2(g);ΔH=177.7kJ/mol
②C(s) + H2O(g)="=" CO(g) + H2(g);ΔH= -131.3kJ/mol
③0.5H2SO4(l) + NaOH(l) ="=" 0.5Na2SO4(l) + H2O(l);ΔH= -57.3kJ/mol
④C(s) + O2(g) ="=" CO2(g);ΔH=-393.5kJ/mol
⑤CO(g) + 1/2 O2(g) ="=" CO2(g);ΔH=-283kJ/mol
⑥HNO3(aq) + NaOH(aq) ="=" NaNO3(aq) + H2O(l);ΔH= -57.3kJ/mol
⑦2H2(g) + O2(g) ="=" 2H2O(l);ΔH= -517.6kJ/mol
(a)上述热化学方程式中,不正确的有
(b)根据上述信息,写出C转化为CO的热化学方程式_ 。
(2)已知热化学方程式:H2(g)+1/2O2(g) ===H2O(g) △H=-241.8kJ•mol-1,该反应的活化能为167.2 kJ•mol-1,则其逆反应的活化能为 

(3)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g)ΔH=-574 kJ·mol-1
CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g)ΔH=-1 160 kJ·mol-1
若用标准状况下4.48 L CH4还原NO2生成N2,反应中转移的电子总数为________(阿伏加德罗常数用NA表示),放出的热量为________kJ。
向2L密闭容器中加入0.15 mol·L-1A、0.05 mol·L-1C和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如图中甲图所示[t0~t1时c(B)未画出,t1时增大到0.05 mol·L-1]。乙图为t2时刻后改变反应条件,平衡体系中正、逆反应速率随时间变化的情况。
(1)若t4时改变的条件为减小压强,则B的起始物质的量为____________mol。
(2)若t5时改变的条件是升温,此时v(正)>v(逆),若A的物质的量减少0.03 mol时,容器与外界的热交换总量为a kJ,写出反应的热化学方程式:_______________________。
(3)t3时改变的某一反应条件可能是________(选填序号)。
A.t3时刻,增大了X的浓度 B.t3时刻,升高了体系温度
C.t3时刻,缩小了容器体积 D.t3时刻,使用了催化剂
(4)在恒温恒压下通入惰性气体,v(正)_________v(逆)(填“>”、“=”或“<”)。
(5)如图两个容器A、B中,A容器的容积保持不变,B容器保持和外界大气压一致。开始时,在保持两个容器体积相等的情况下,分别同时充入2moLH2S和1moLSO2。反应开始后两容器内反应平均反应速率A B (填“大于”、“小于”或“等于”)。