.由氢气和氧气反应生成1mol水蒸气放热241.8KJ,写出该反应的热化学方程式:
_____________________ _ 。
甲醇是重要的化工原料,在工业生产上的应用十分广泛,二氧化碳被认为是加剧温室效应的主要来源,如何有效地开发利用CO2引起了全世界的普遍重视。为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究。
(1)将CO2转化成甲醇燃料是减排、环保的一种科学方法。
已知:2H2(g)+O2(g) =2H2O(g);△H=-483. 6kJ·mol-1 ①
2CO2(g)+4H2O(g) 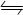 2CH3OH(g)+3O2(g);ΔH=+1352.8kJ·mol-1②
2CH3OH(g)+3O2(g);ΔH=+1352.8kJ·mol-1②
则反应:CO2(g)+3H2(g) 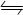 CH3OH(g)+H2O(g)的ΔH=。
CH3OH(g)+H2O(g)的ΔH=。
(2)500 ℃时,在体积为1 L 的固定容积的密闭容器中充入1mol CO2、3mol H2,测得CO2浓度与CH3OH 浓度随时间的变化如图所示,回答下列问题: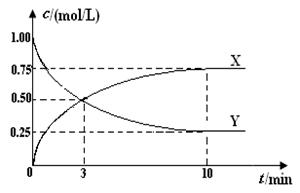
①计算从反应开始到10min时,H2的反应速率及该温度下反应的平衡常数。
(写出具体的计算过程)
②下列措施不能使CO2的转化率增大的是______(双选)。
| A.在原容器中再充入lmol CO2 |
| B.在原容器中再充入1mol H2 |
| C.将反应体系温度降低 |
| D.使用更有效的催化剂 |
③升高温度,800℃时,在体积为1 L 的固定容积的密闭容器中充入1mol CO2、3mol H2,在上图中画出CH3OH 浓度随时间变化的曲线(不需要定量计算)。
有四种短周期元素,它们的结构、性质等信息如下表所述:
| 元素 |
结构、性质等信息 |
| X |
构成有机物的核心元素,该元素的一种氧化物和气态氢化物都是典型的温室气体 |
| Y |
短周期中(除稀有气体外)原子半径最大的元素,该单质液态时可用作核反应堆的传热介质 |
| Z |
与Y同周期,其最高价氧化物的水化物呈两性 |
| M |
海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂 |
请根据表中信息填写:
(1)X元素在周期表中的位置是______________,其相对分子质量最小的气态氢化物的化学式是______________。
(2)Y离子半径比Z离子的半径______(填“大”或“小”),Y元素的最高价氧化物的水化物和Z元素的最高价氧化物相互反应的离子方程式是:_____________________。
(3)X与M两元素的气态氢化物的稳定性更强的是______________(填化学式),请再举出一个实例比较M与X两元素的非金属性强弱(用化学方程式表示)______________。
工业制硫酸生产流程如下图:
(1)实验室常用过量的氢氧化钠溶液吸收SO2尾气,该反应的离子方程式为。
(2)已知SO2和O2生成SO 3的反应过程放热。在催化反应室中,下列措施有利于提高SO2平衡转化率的有。(填写编号)
A.减少压强 B.升高温度 C.不断补充空气 D.及时分离出SO3
(3)在工业制硫酸生产中,为提高催化剂效率采取的措施有(答出2点)。
(4)在450℃、常压和钒催化条件下,在容积为2L的恒容容器中加入2molSO2和1molO2 。
①下列选项中不能作为判断该反应是否达平衡状态的标志的是。(填写编号)
A.混合气密度不变化
B.SO2百分含量保持不变
C.容器中气体的压强不变
D.SO3的生成速率与SO2的消耗速率相等
E.气体总物质的量不变
②达平衡后,测得平衡常数为K,若此时O2的转化率为x,则K和x的关系满足K=。
(5)SO2和O2的反应在恒容密闭容器中发生,图1、2表示在时刻t1达到平衡、在时刻t2因改变某个条件而发生变化的情况,根据图1、图2相关信息,判断t2发生改变的条件是。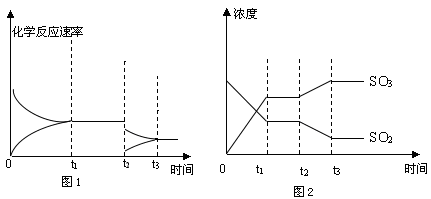
某同学使用石墨电极,在不同电压(x)下电解pH=1的0.1 mol·L-1 FeCl2溶液,实验记录如下(a、b、c代表电压值):
| 序号 |
电压/V |
阳极现象 |
检验阳极产物 |
| Ⅰ |
x≥a |
电极附近出现黄色,有气泡产生 |
有Fe3+、有Cl2 |
| Ⅱ |
a>x≥b |
电极附近出现黄色,无气泡产生 |
有Fe3+、无Cl2 |
| Ⅲ |
b>x>0 |
无明显变化 |
无Fe3+、无Cl2 |
(1)用KSCN溶液检验出溶液中含Fe3+,看到的现象是_____。
(2)Ⅰ中,Fe3+产生的原因可能是Cl-在阳极放电,生成的Cl2将Fe2+氧化。写出Cl2氧化Fe2+的离子方程式:______________________________________。
(3)由Ⅱ推测,Fe3+产生的原因还可能是Fe2+在阳极放电。原因是Fe2+具有____性。
(4)Ⅱ中虽未检验出Cl2,但Cl-在阳极是否放电仍需进一步验证。控制变量,做对照实验继续探究:电解pH=1的NaCl溶液,记录如下:
| 序号 |
电压/V |
阳极现象 |
检验阳极产物 |
| Ⅳ |
a>x≥c |
无明显变化 |
有Cl2 |
| Ⅴ |
c>x≥b |
无明显变化 |
无Cl2 |
①NaCl溶液的浓度应是______mol·L-1。
②Ⅳ中检验Cl2的实验方法:________________________________。
③与Ⅱ对比,得出的结论:通过控制电压,证实了产生Fe3+的两种原因都成立;通过控制电压,验证了放电顺序是:Fe2+___________Cl-(填“>”或“<”)
(14分)对金属制品进行抗腐蚀处理,可延长其使用寿命。
(1)以下为铝材表面处理的一种方法:
①碱洗的目的是除去铝材表面的自然氧化膜。碱洗时常有气泡冒出,该气体的名称为。
②为将碱洗槽液中的铝元素以沉淀形式回收,最好向槽液中加入下列试剂中的。
A.NH3 B.CO2 C.NaOHD.HNO3
③以铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极电极反应式为。
(2)镀铜可防止铁制品腐蚀,电镀时用铜而不用石墨作阳极的原因是。
(3)下列关于金属腐蚀的事实中,与电化学腐蚀有关的是
A.埋在潮湿土壤里的铁管比埋在干燥土壤里的铁管更易被腐蚀
B.为保护海轮的船壳,常在船壳上镶入锌块
C.在空气中,金属银的表面生成一层黑色物质
D.镀银的铁制品,镀层部分受损后,露出的铁表面易被腐蚀
(4)利用下图装置,可以模拟铁的电化学防护。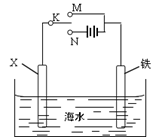
①若X为碳棒,为减缓铁的腐蚀,开关K应置于处。
②若X为锌,开关K应置于处。