合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:N2(g)+3H2(g) 2NH3(g),500 K、30 MPa下n(NH3)、n(H2)和n(N2)随时间变化的关系如图所示。
2NH3(g),500 K、30 MPa下n(NH3)、n(H2)和n(N2)随时间变化的关系如图所示。
请回答下列问题:
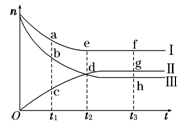
(1)上图中属于氢气物质的量随时间变化的曲线是 (填“Ⅰ”、“Ⅱ”或“Ⅲ”)。
(2)关于t2时刻的说法正确的是____________。
A.t2时该反应达到平衡状态
B.t2时Ⅱ和Ⅲ代表的物质反应速率相同
C.t2时氢气、氮气与氨气的反应速率之比为3∶1∶2
D.t2时氨气与氢气的物质的量相同
(3)对于Ⅱ所代表的物质,其逆反应速率最大的点是___________(填“c”、“d”或“g”);对于Ⅰ所代表的物质,其正反应速率最小的点是_____________(填“a”、“e”或“f”)。
(4)其他条件不变,只改变温度,在改变的这个温度下反应至t3时刻,此时n(H2)比图象中的值大,那么该温度可能是 。
A.673 K B.273 K C.373 K
(5)在密闭容器中充入2 mol N2和6 mol H2,一定条件下建立平衡:N2(g)+3H2(g) 2NH3(g) ΔH=-92.2 kJ/mol,测得N2的转化率为90%,则在此条件下,反应放出的热量为 kJ。若与上述反应的温度和体积相同时,向密闭容器中充入4 mol NH3,则达平衡后,反应 (填“放出”或“吸收”)的热量为 kJ。
2NH3(g) ΔH=-92.2 kJ/mol,测得N2的转化率为90%,则在此条件下,反应放出的热量为 kJ。若与上述反应的温度和体积相同时,向密闭容器中充入4 mol NH3,则达平衡后,反应 (填“放出”或“吸收”)的热量为 kJ。
有机物F、G是常见的塑料,可通过下图所示路线合成: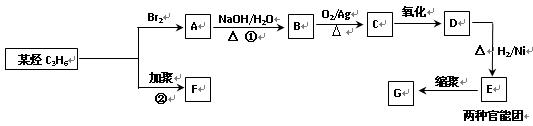
(1)高分子化合物G的结构简式是 。
(2)反应②的化学方程式是 。
(3)PBT(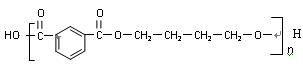 )是一种重要的工程塑料。
)是一种重要的工程塑料。
结合所学知识,请设计方案以CH2=CHCH=CH2 、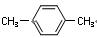 为原料合成PBT(请用反应流程图表示,并注明反应条件)。
为原料合成PBT(请用反应流程图表示,并注明反应条件)。
示例:由乙醇合成聚乙烯的反应流程图可表示为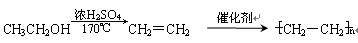
合成PBT的反应流程图为:
___________________________________________________________________________
某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2。
已知该反应中H2O2只发生如下过程:H2O2 → O2
(1)写出该反应的化学方程式,并标出电子转移的方向和数目。
(2)该反应中的氧化剂是。
(3)若反应转移了0.3 mol电子,则产生的气体在标准状况下体积为。
两种气态烃A、B组成的混合气体完全燃烧后得到CO2和H2O(g)的物质的量随混合烃的总物质的量的变化如图所示,则
(1)混合烃中n(C):n(H)=
(2)混合烃中一定有
(3)若相对分子质量A<B,试推断混合气体中A和B所有可能的组合及其物质的量之比,并将结果填入下表(有几组填几组,不一定填满)
| 组合编号 |
A的分子式 |
B的分子式 |
A和B的物质的量比 |
| ① |
|||
| ② |
|||
| ③ |
|||
| ④ |
|||
| ⑤ |
已知:
(1)傅瑞德尔一克拉福茨反应是在苯环上引入烷基的反应:
(2)
(3)烯烃与HX(X为原子或原子团)加成时,氢原子总是加在含氢较多的不饱和碳上,
即:
某同学给出了以乙烯、苯、食盐、水等为原料合成 的部分流程图:
的部分流程图:
试回答下列问题:
(1)反应物A可由食盐、水经一系列反应获得,则反应物A为(填化学式),写出制备A 的化学方程式
(2)反应物B为(填化学式)
(3)反应Ⅰ~ Ⅳ中,属于加成反应的是(填序号)
(4)中间产物C的属于芳香烃的同分异构体有种(不包括自身),其中苯环上的一氯代物有2种的是(写结构简式)
(5)下列关于中间产物D的说法不正确的是
| A.既能使酸性高锰酸钾溶液褪色,也能使溴水褪色 |
| B.既能溶于水,也能溶于苯中 |
| C.1mol 中间产物D最多可与4mol H2完全反应 |
| D.所有原子不可能共平面 |
我国著名化学家傅鹰告诫我们“化学给人以知识,化学史给人以智慧。”回顾苯的结构的探索历程,曾有人提出两种立体结构: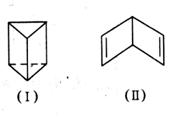

就上述两种立体结构回答下列有关问题:
(1)若苯的结构为(Ⅰ),则在下列项目中它与苯的凯库勒式结构不同的是__________
A.一氯代物种数 B.二氯代物种数
C.与溴水的作用 D.燃烧时烟的浓度
(2)若苯的结构为(Ⅰ),则能解释下列说法中的
A.不能使酸性高锰酸钾溶液褪色 B.苯的邻位二氯代物没有同分异构体
C.在一定条件下能和氢气发生加成反应 D.和氯气在一定条件下发生取代反应
(3)若苯的结构为(Ⅱ),则苯(填“能”或“不能”)使溴水反应褪色?若能,请写
出一个可能反应的化学方程式;若认为不能,请说明原因。