硫-氨热化学循环制氢示意图如下:
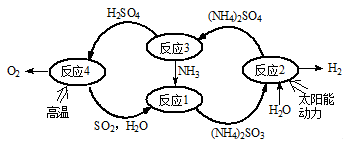
(1)反应1的离子方程式为 。
(2)反应2能量转化主要方式为 。
(3)反应3中控制反应条件很重要,不同条件下硫酸铵分解产物不同。若在400℃时分解,产物除水蒸气外还有A、B、C三种气体,A是空气中含量最多的单质,B能使湿润的红色石蕊试纸变蓝,C能使品红溶液褪色。则400℃时硫酸铵分解的化学方程式为 。
(4)反应4是由(a)、(b)两步反应组成:
H2SO4(l) =SO3(g) +H2O(g),△H=+177kJ•mol-1 …………(a)
2SO3(g) 2SO2(g) + O2(g),△H="+196" kJ•mol-1…………(b)
2SO2(g) + O2(g),△H="+196" kJ•mol-1…………(b)
①则H2SO4(l)分解为SO2(g)、O2(g)及H2O(g)的热化学方程式为: 。
②在恒温密闭容器中,控制不同温度进行SO3分解实验。以SO3起始浓度均为cmol·L-1,测定SO3的转化率,结果如右图,图中Ⅰ曲线为SO3的平衡转化率与温度的关系,Ⅱ曲线表示不同温度下反应经过相同反应时间且未达到化学平衡时SO3的转化率。

i)图中点X与点Z的平衡常数K:K(X) K(Z)(选填:>,<,=);
ii)Y点对应温度下的反应速率:v(正) v(逆)(选填:>,<,=);
iii)随温度的升高,Ⅱ曲线逼近Ⅰ曲线的原因是: 。
(1)赤铜矿的主要成分是Cu2O,辉铜矿的主要成分是Cu2S。赤铜矿与辉铜矿混合加热发生以下反应:Cu2S+2Cu2O===6Cu+SO2。氧化剂是________,还原剂是________每生成19.2 g Cu,反应中转移电子数_________
(2)已知8NH3+3Cl2 = 6NH4Cl+N2,氧化剂与还原剂的分子个数比为________;当有4mol NH3被氧化时,生成的还原产物为________ g。
(1)在标准状况下,CO和CO2混合气体的密度是相同条件下H2密度的16倍,则该混合气体的平均相对分子质量为______________ ;若在该条件下混合气体的物质的量为1mol,则其中CO所占的体积为______________ ,CO2所占的质量为__________________。
(2)NaHSO4在水中的电离方程式: ___________;
若将NaHSO4与Ba(OH)2在溶液中按物质的量2:1混合,反应的离子方程式是______________
有下列物质:① 氢氧化铜固体;② 铜丝;③ 氯化氢气体;④ 稀硫酸;⑤ 二氧化碳气体;⑥ 氨水;⑦ 碳酸钙固体;⑧ 蔗糖晶体;⑨ 熔融氯化钠;⑩醋酸;请用序号填空:
(1)上述状态下可导电的是_________________________;
(2)属于弱解质的是_____________________________;
(3)属于非电解质的是_____________________________;
实验表明,液态时,纯硫酸的电离能力强于纯硝酸,纯硫酸的导电性也显著强于纯水。又知液态纯酸都能像水那样进行自身电离(H2O+H2O H3O++OH-)而建立平衡,且在一定温度下都有各自的离子积常数。据此回答:
H3O++OH-)而建立平衡,且在一定温度下都有各自的离子积常数。据此回答:
(1)纯硫酸在液态时自身电离的方程式是________________。
(2)25 ℃时,液态纯硫酸的离子积常数K(H2SO4)___________1×10-14(填“>”、“<”或“=”)。
(3)在纯硫酸与纯硝酸的液态混合酸中,存在的阴离子主要是____________,这是因为混合酸中不仅存在硫酸和硝酸各自电离的两个电离平衡,而且还因硫酸的酸度大于硝酸,又在无水条件下,混合酸中必然发生____________(写离子方程式)反应。
围绕下列七种物质:①铝、②Al2O3、③稀硝酸、④H2SO4、⑤Ba(OH)2固体、⑥稀氨水、⑦Al2(SO4)3、⑧NaOH溶液,按要求回答下列问题:
(1)既能与强酸反应,又能与强碱反应的是_____________(填序号);
(2)属于电解质的是_____________(填序号);
(3)写出最适宜制取Al(OH)3的离子方程式_____________;
(4)两物质间发生反应的离子方程式为H++OH-=H2O,请写出该反应的化学方程式_____________;
(5)写出①和⑧反应的离子方程式________________________;
(6)34.2g⑦溶于水配成500mL溶液,则溶液中SO42-的物质的量浓度为_____________。